bazno centrirana ortorompska rešetka → base-centered orthorhombic lattice
Bazno centrirana ortorompska rešetka (označava se sa C), kao i sve ostale rešetke ima po jedan čvor kristalne rešetke u svakom uglu jedinične ćelije plus po jedan dodatni čvor na sredini dvije paralelne stranice jedinične ćelije. Kristalografski vektori jedinične ćelije su a≠b≠c a kutovi među njima α=β=γ=90°.
benzen → benzene
Benzen (benzol), C6H6, najjednostavniji je aromatski ugljikovodik, lako hlapiva tekućina karakteristična mirisa, vrelišta 80 °C, netopljiva u vodi, topljiva u benzinu, alkoholu i eteru. Gori jako čađavim plamenom, a pomiješan sa zrakom stvara eksplozivnu smjesu. Pare su mu vrlo otrovne.
Njemački kemičar Friedrich August Kekulé je, 1865., predložio strukturu molekule benzena kao heksagonalni prsten koji se sastoji od šest atoma ugljika s naizmjeničnim jednostrukim i dvostrukim ugljik-ugljik vezama. Takva struktura kaže da bi benzen trebao biti vrlo reaktivan ali to nije slučaj. Mi danas znamo da je struktura benzena doista šesterokutna, kod koje su sve C-C veze jednake i čija se duljina nalazi između onih za jednostruku i dvostruku vezu. To je objašnjeno time da se π-orbitale susjednih ugljikovih atoma preklapaju i tvore delokaliziranu molekulsku orbitalu koja se proteže oko prstena, dajući mu dodatnu stabilnost i sukladno tomu smanjenu reaktivnost. To je razlog zašto se strukturna formula benzena predstavlja kao šesterokut s krugom u sredini koji predstavlja delokalizirane elektrone.
ekvivalentna masa → equivalent weight
Ekvivalentna masa tvari koja sudjeluje u neutralizacijskoj reakciji jest ona količina tvari (molekule, iona ili ionskog para) koja ili reagira s 1 mol vodikovih iona u toj reakciji ili ga proizvodi.
Ekvivalentna masa sudionika oksidacijsko/redukcijske reakcije jest ona masa tvari koja izravno ili neizravno troši 1 mol elektrona.
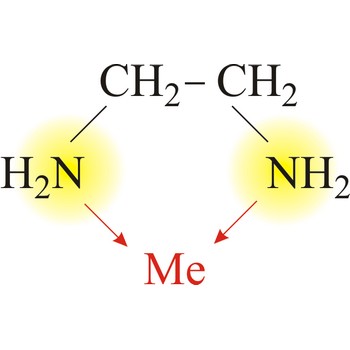
bidentatni ligand → bidentate ligand
Bidentatni ili dvozubi ligandi imaju dva donorska atoma s nepodijeljenim elektronskim parovima koji se mogu vezati s dvije koordinacijske veze na centralni atom. Primjer bidentatnog liganda je etilendiamin. Jedna molekula etilendiamina formira dvije veze s metalnim ionom. Tako se na centralni atom s kordinacijskim brojm 4 vežu dvije molekule etilendiamina a na onaj s koordinacijskim brojem 6 tri molekule.
borani → borane
Borani su spojevi bora s vodikom (B2H6, B4H10, B5H9, B5H11...). Općenito se mogu dobiti djelovanjem kiseline na magnezijev borid Mg3B2. Svi borani su i po formuli i po strukturi iznenađujući spojevi. Sve više postaje prihvatljiva ideja da se borani smatraju spojevima koji sadrže tzv. tricentričnu vezu koja se sastoji od jednog elektronskog para koji obuhvaća tri atoma, što bi moglo biti u suglasnosti s teorijom molekulskih orbitala.
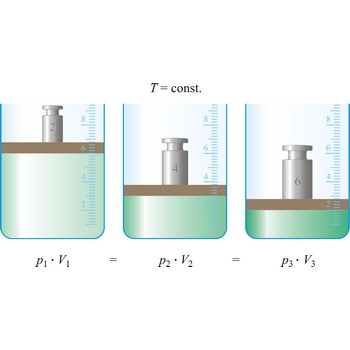
Boyleov zakon → Boyle’s law
Boyleov zakon (poznat i kao Boyle-Mariotteov zakon) kaže da je volumen plina pri stalnoj temperaturi obrnuto proporcionalan tlaku (p · V = konstanta).
brom → bromine
Brom je 1826. godine otkrio Antoine J. Balard (Francuska). Ime mu dolazi od grčke riječi bromos što znači smrad. To je tamno crvena do smeđa tekućina s zagušljivim, nadražujućim parama. Podržava gorenje i jaki je oksidans. Dobro se otapa u vodi stvarajući bromnu vodu. U prirodi se nalazi skoro isključivo kao bromid. Bromne pare su otrovne. Na koži izaziva teške rane koje teško zacjeljuju. Brom se u prirodi nalazi u redovito zajedno s klorom ako natrij bromid NaBr) i magnezij bromid (MgBr2). Dobiva se uvođenjem elementarnog klora u vodenu otopinu bromnih soli. Upotrebljava se u organskoj sintetskoj industriji i za izradu fotografskih emulzija.
isparavanje → evaporation
Isparavanje je pretvorba tekućine u paru na temperaturama ispod njenog vrelišta.
temperatura zapaljenja → flash point
Temperatura zapaljenja najniža je temperatura na kojoj para tekućine ili hlapljive čvrste tvari stvara zapaljivu smjesu sa zrakom. Pri temperaturi zapaljenja pare blizu površine tekućine zapale se kada se izlože plamenu.
mehanika fluida → fluid mechanics
Mehanika fluida bavi se proučavanjem različitih svojstava fluida (tekućina i plinova): brzine, tlaka, gustoće i temperature kao funkcije prostora i vremena.
Citiranje ove stranice:
Generalić, Eni. "Tlak pare." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav