graduirana pipeta → graduated pipette
Graduirane pipete (Mohrove pipete) imaju skalu razdijeljenu na jedinice i desetinke mililitra. Zbog svog širokog vrata manje su precizne od prijenosnih pipeta i koriste se pri uzimanju volumena otopina čija točnost ne mora biti velika. Usisavanjem (ustima, propipetom ili vodenom sisaljkom) povuče se tekućina malo iznad oznake i otvor pipete zatvori vrškom kažiprsta. Obriše se vanjska stjenka pipete i laganim popuštanjem kažiprsta tekućina se ispusti do oznake 0. Pipeta se prazni tako da maknemo kažiprst i pustimo da tekućina slobodno istječe do željene oznake.
staklena elektroda → glass electrode
Staklena elektroda je elektroda osjetljiva na vodikove ione. Sastoji se od staklene membrane, unutarnje referentne elektrode i unutarnje otopine. Može se također prirediti i staklena elektroda osjetljiva na natrijeve ione.
Staklena elektroda ima ekstremno velik električni otpor. Membrana tipične staklene elektrode (debljine od 0.03 mm do 0.1 mm) ima električni otpor od 30 MΩ do 600 MΩ). Aktivitet vodikovih iona u unutrašnjoj otopini je stalan. Površina staklene membrane mora biti hidratizirana da bi djelovala kao pH elektroda. kada se staklena membrana uroni u vodenu otopinu na njenoj površini se formira tanki gel sloj pri čemu dolazi do ionske izmjene između iona natrija u kristalnoj rešetki stakla i vodikovog iona. Ista stvar se dešava i na unutrašnjoj strani membrane.
Najjednostavnije objašnjenje rada staklene membrane je da se staklo ponaša kao slaba kiselina (staklo-H).
Aktivitet vodikovih iona u unutrašnjoj otopini je stalan. Kada se na vanjskoj strani staklene membrane promijeni koncentracija vodikovih iona staklo će se protonirati ili deprotonirati. Razlika pH otopina s unutrašnje i vanjske strane staklene membrane stvara elektromotornu silu proporcionalnu toj razlici.
grafit → graphite
Grafit je alotrop ugljika. Dobar je vodič topline i elektriciteta. U grafitu atomi su povezani u heksagonalne prstenove koji su složeni u slojevima. Kako ovi slojevi lako klize jedan preko drugog grafit se često koristi kao kruto mazivo. Sintetski grafit dobiva se zagrijavanjem smjese gline (aluminijeva silikata) i koksa u procesu koji je izumio američki kemičar Edward Goodrich Acheson (1856.–1931.). U reakciji nastaje silicijev karbid koji pri 4150 °C gubi silicij ostavljajući čisti grafit.
glikozid → glycoside
Glikozidi su skupina organskih spojeva u kojoj je šećerna skupina (glikon), preko svog anomernog ugljikovog atoma, glikozidnom vezom povezana s nekom drugom skupinom - aglikonom. Prema IUPAC-ovoj definiciji svi disaharidi i polisaharidi su također glikozidi u kojima je aglikon također šećer.
Vodene otopine cikličkih poluacetala ili poluketala šećera spontano uspostavljaju ravnotežu između α i β anomera koji prelaze jedan u drugi preko otvorenog aldehidnog oblika. Međutim, kada se glikozidna veza formira anomerna konfiguracija ostaje zaključana. α i β glikozidi imaju različita kemijska, fizikalna i biološka svojstva.
Naziv glikozid je naknadno proširen tako da obuhvaća ne samo veze između anomernog ugljikovog atoma, i -OR skupine već i njegove veze sa -SR (tioglikozidi) i -SeR (selenoglikozidi). Nazivi N-glikozid (za anomerni C-atom vezan na -NR1R2) i C-glikozid (za anomerni C-atom vezan na -CR1R2R3), iako su široko rasprostranjeni u biokemijskoj literaturi, pogrešni su i ne bi ih se smjelo koristiti.
gravimetrija → gravimetry
Gravimetrija je kvantitativna metoda analize koja se sastoji u tome da se tražena tvar taloženjem prevede u teško topljivi spoj, filtriranjem odijeli od otopine, ispere pogodnim sredstvom za ispiranje, filtrira, suši ili žari i na kraju važe. Iz mase taloga poznatog sastava i njegove molarne mase izračunamo količinu tražene tvari.
Haberov proces → Haber process
Haberov proces je industrijski postupak sinteze amonijaka iz dušika i vodika:
Reakcija je egzotermna i reverzibilna, tako da se prinos na amonijaku povećava na nižim temperaturama. Brzina reakcije je previše mala na normalnoj temperaturi, pa se reakcija provodi pri optimalnoj temperatura od oko 450 °C. U reakciji se kao katalizator koristi željezo s aluminijevim oksidom kao promotorom. Povišenjem tlaka reakcija se pomiče u smjeru nastajanja amonijaka, pa se koristi tlak od 250 atmosfera. Amonijak se uklanja iz reaktora čime se reakcija pomiče u smjeru nastajanja produkata. Kao izvor vodika u originalnom procesu koristio se vodeni plin, dok se danas koristi vodik dobiven reformiranjem zemnog plina.
Proces je vrlo važan jer je to jedini industrijski način fiksacije dušika iz zraka u svrhu dobivanja umjetnih gnojiva i eksploziva. Postupak je razvio 1908. njemački kemičar Fritza Haber (1868.-1934.), a za industrijsku primjenu prilagodio ga je Carl Bosh (1874.-1940.), te se postupak još naziva Haber-Boshov postupak.
Gratzelova sunčeva ćelija → Gratzel solar cell
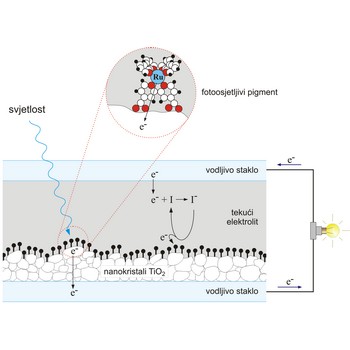
Grätzelova sunčeva ćelija je fotoelektrokemijska ćelija koju je razvio Michael Grätzel sa suradnicima. Oponaša djelomice prirodnu sunčevu ćeliju, koja omogućava biljkama da ostvare fotosintezu. U prirodnoj sunčevoj ćeliji molekule klorofila apsorbiraju svjetlost i to najjače u crvenom i plavom dijelu spektra, dok se zelena svjetlost reflektira. Apsorbirana energija dovoljna je za izbacivanje elektrona iz pobuđenog klorofila. U prijenosu tog naboja, sudjeluju potom druge molekule. U Grätzelovoj ćeliji su, također, za stvaranje naboja apsorpcijom svjetlosti i prijenos tog naboja "zaduženi" različiti dijelovi ćelije.
Na vodljivo staklo nanesen je sloj nanokristala poluvodiča TiO2 čija je površina jako velika. Na TiO2 nanesen je fotoosjetljivi pigment koji čine rutenijevi ioni povezani s organskim molekulama koje jako apsorbiraju vidljivu svjetlost. Fotopobuđeni elektroni prelaze s rutenijevih iona na kristalite TiO2, koji ih odvode daleko od iona-donora. Čitav sustav uronjen je u tekući jodidni elektrolit koji preuzima elektrone s elektrode i prenosi ih na rutenijeve ione kako bi se nastavio proces apsorpcije svjetlosti.
Efikasnost ovih ćelija iznosi oko 10 % i raste u difuznoj svjetlosti, tj. za oblačna vremena.
polučlanak → half-cell
Polučlanak je dio galvanskog članka u kojem dolazi do oksidacije ili do redukcije elementa u dodiru s vodom ili vodenom otopinom jednog od njegovih spojeva.
halogenirani ugljikovodik → halocarbon
Halogenirani ugljikovodici su spojevi koji sadržavaju samo ugljik, jedan ili više halogena, i ponekad vodik, primjerice ugljikov tetraklorid ili tetraklorometan (CCl4), tetrabromometan (CBr4). Niži članovi različitih homolognih nizova koriste se kao sredstva za hlađenje, sredstva za gašenje požara i kao sredstva za pjenjenje poliuretanske pjene. Polimerizacijom halogeniranih ugljikovodika nastaju plastične mase koje karakterizira visoka kemijska otpornost, visoka električna otpornost i dobra toplinska stabilnost.
helij → helium
Helij su 1868. godine otkrili Pierre Jules César Janssen (Francuska) i Sir William Ramsay (Škotska). Ime mu dolazi od grčke riječi helios što znači sunce. To je plin bez boje i mirisa koji se u prirodi pojavljuje kao jednoatomni. Helij je kemijski inertan, nezapaljivi plin koji se ne spaja s drugim elementima. Prvi put pronađen je u spektru sunčevog zračenja. Helij je drugi element, iza vodika, po rasprostranjenosti u cijelom svemiru. Nastaje raspadom radioaktivnih elemenata, a industrijski se proizvodi iz zemnog plina iz Teksasa (SAD) u kojem ga ima oko 2 % (volumna). Upotrebljava se za punjenje balona, a smjesa koja se sastoji od 21 % O2 i 79 % He koristi se kao zamjena za zrak kod ronjenja na velikim dubinama.
Citiranje ove stranice:
Generalić, Eni. "Teška voda." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav