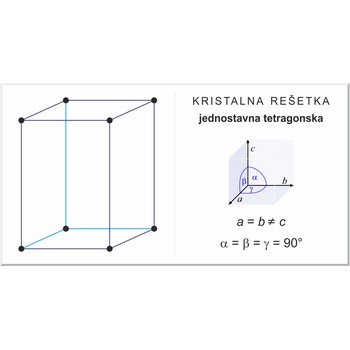
jednostavna tetragonska rešetka → simple tetragonal lattice
Jednostavna ili primitivna tetragonska rešetka (označava se sa P) ima po jedan čvor kristalne rešetke u svakom uglu jedinične ćelije. Kristalografski vektori jedinične ćelije su a=b≠c kutovi među njima α=β=γ=90°.
sunčeva ćelija → solar cell
Sunčeva ili fotonaponska ćelija jest naprava koja sunčevu svjetlost pretvara u elektricitet. Sve sunčeve ćelije koriste se fotonaponskom pojavom, pa se često zovu fotonaponskim napravama. U većini ovih ćelija osnovni materijal čine poluvodiči, a najčešći je silicij.
Fotonaponska pojava zasniva se na stvaranju pokretnih nositelja naboja - elektrona i šupljina - uslijed apsorpcije fotona svjetlosti. Ovaj par naboja stvara se kad elektron u najvišoj popunjenoj elektronskoj vrpci poluvodiča (valentnoj vrpci) apsorbira foton dostatne energije i prijeđe u praznu elektronsku vrpcu (vodljivu vrpcu). Ovo pobuđenje može se inducirati samo fotonom čija energija odgovara širini energijskog procjepa koji razdvaja valentnu i vodljivu vrpcu. Stvaranje para naboja elektron-šupljina može se pretvoriti u električnu struju u poluvodičkoj napravi, u kojoj je sloj jednog poluvodiča spojen sa slojem drugačijeg poluvodiča ili pak metala. U većini poluvodičkih ćelija ovaj je spoj takozvani p-n spoj, tj. sučeljavaju se p-dopirani i n-dopirani poluvodič. Na sučelju višak pozitivnog naboja (šupljina) u p-dopiranom poluvodičkom sloju i višak negativnog naboja (elektrona) u n-dopiranom poluvodičkom sloju stvara električno polje, koje se prostire s obje strane sučelja. Kad se apsorpcijom fotona u ovom području stvori par elektron-šupljina, ovi naboji se, zbog djelovanja polja, udaljuju od sučelja krećući se u suprotnim smjerovima prema vrhu i dnu ćelije, gdje se nalaze metalne elektrode za skupljanje struje. Elektroda na vrhu (kroz koju se apsorbira svjetlost ) podijeljena je na trake tako da ne zaklanja poluvodički sloj. U većini komercijalnih ćelija p-n spoj se formira unutar monolitnog komada kristalnog silicija. Silicij apsorbira sunčevu svjetlost onih valnih duljina pri kojima je najintenzivnija, od bliskog infracrvenog područja (valnih duljina oko 1200 nm) do ljubičastog (valnih duljina oko 350 nm).
spin → spin
Spin je unutrašnji kinetički moment osnovne čestice, ili sustava čestica kao što je npr. jezgra. Također je odgovoran za magnetski moment čestice. Spinovi jezgara imaju karakteristične fiksne vrijednosti. Parovi neutrona i protona poredaju se tako da se njihovi spinovi ponište, tako da će jezgre s neparnim brojem neutrona i/ili protona imati kvantni nuklearni spinski broj različit od nule.
Stern-Gerlachov su 1921. ustanovili da se utjecajem nehomogenoga magnetskog polja na mlaz atoma srebra ovaj cijepa u dva snopa, jedan paralelan a drugi antiparalelan magnetskom polju.
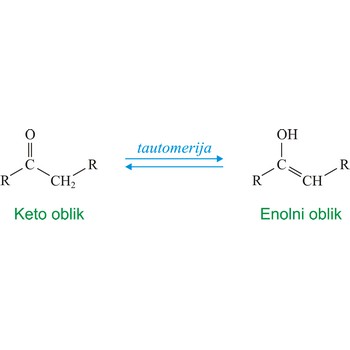
tautomerija → tautomerism
Tautomerija je izraz koji se odnosi na ravnotežu dviju različitih struktura istog spoja. Obično se tautomeri razlikuju u mjestu spajanja vodikovog atoma. Najčešći primjer tautomernog sustava je ravnoteža između ketona (keto) i aldehida (enol).
suzavac → tear gas
Suzavci su zajedničko ime za tvari koje, u niskim koncentracijama, uzrokuju bol u očima, suzenje i nemogućnost držanja otvorenih očiju. Suzavci se koriste uglavnom u vojnim vježbama i policijskim akcijama, ali su također korišteni i kao sredstva za ratovanje. Iritirajući plinovi su bili korišteni i u antičkim ratovima, ali se tek nakon Drugog svjetskog rata sustavnije istražuju. Tri najvažnija predstavnika suzavaca jesu: kloroacetofenon (CN), orto-klorobenziliden-malononitril (CS) i dibenz(b,f)-1,4-oksazepine (CR). Učinkoviti su a rizičnost po zdravlje je niska.
tehnecij → technetium
Tehnecij je 1937. godine otkrio Carlo Perrier i Emilio Segre (Italija). Ime je dobio prema grčkoj riječi technetos što znači umjetan jer je prvi element dobiven umjetnim putem. To je srebrni metal ili sivi prah. Otporan je na oksidaciju ali potamni na vlažnom zraku i gori u visokoj koncentraciji kisika. Topljiv je u nitratnoj i sulfatnoj kiselini ali nije topljiv u kloridnoj kiselini, neovisno o njenoj koncentraciji. Tehnecij je radioaktivan. Dobar je inhibitor korozije čelika, ali je, zbog svoje radioaktivnosti, upotrebljiv samo za zatvorene sustave.
termodinamički zakoni → thermodynamic laws
Termodinamički zakoni temelj su termodinamike:
Prvi zakon ili zakon o očuvanju energije glasi: "Suma svih oblika energije u zatvorenom sustavu konstantna je."
Drugi zakon: "Toplina ne može sama od sebe prijeći s hladnijeg na toplije tijelo, i to ni neposredno ni posredno."
Treći zakon: "Entropija savršenog kristala približava se nuli kako se termodinamička temperatura približava nuli."
prijelazni element → transition metal
Prijelazni elementi smješteni su središnjem dijelu periodnog sustava, u skupinama od 3. do 11. Popunjavaju d-podljuske prethodne ljuske, te ih zbog toga nazivamo i d-elementima.
Prvom nizu prijelaznih elemenata pripadaju skupine skandija (Sc), titanija (Ti), vanadija (V), kroma (Cr), mangana (Mn), željeza (Fe), kobalta (Co), nikla (Ni) i bakara (Cu). Često se i elementi 12. skupine (skupine cinka) svrstavaju u prijelazne elemente iako su d-podljuske već popunjene kod skupine bakra.
Unutar 6. i 7. periode nalaze se, u 3. podljusci, unutrašnji prijelazni elementi, (lantanoidi) i (aktinoidi). Prijelazni elementi su metali velike gustoće, tvrdoće i visokog tališta. Spojevi su im obično obojeni, a za njih je karakteristično stvaranje kompleksnih spojeva.
triklinska rešetka → triclinic lattice
Triklinska rešetka ima po jedan čvor kristalne rešetke u svakom uglu jedinične ćelije. Kristalografski vektori jedinične ćelije su a≠b≠c a kutovi među njima α≠β≠γ≠90°.
brzina → velocity
Ako se materijalna točka (čestica, sitno tijelo) giba tako da joj se položajni vektor mijenja od nekog početnog rp do konačnog rk, onda je pomak, Δr, materijalne točke
Srednja brzina materijalne točke, v, definira se kao kvocijent pomaka, Δr, i vremenskog intervala, Δt, u kojemu je taj pomak nastao:
Trenutačna brzina, v, dobiva se kao granična vrijednost srednje brzine kad se Δt približava nuli:
Brzina je vektorska veličina. Ako nacrtamo stazu materijalne točke kao krivulju u koordinatnom sustavu, trenutačna brzina u bilo kojoj točki krivulje je uvijek u smjeru tangente na krivulju. Srednja brzina jest, pak, vektor istog smjera kao i vektor pomaka, Δr.
SI jedinica za brzinu je m s-1.
Citiranje ove stranice:
Generalić, Eni. "Romboedarski kristalni sustav." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav