nulti zakon termodinamike → zero law of thermodynamics
Nulti zakon termodinamike glasi: Ako je neko tijelo A u toplinskoj ravnoteži s tijelom B i s tijelom C, onda su i tijela B i C u međusobnoj toplinskoj ravnoteži.
dezoksiribonukleinska kiselina → deoxyribonucleic acid
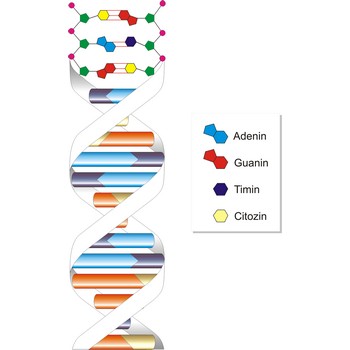
Dezoksiribonukleinska kiselina (DNK ili DNA) molekula je na kojoj se nalaze upute za sintezu specifičnih proteina, tj. za raspored aminokiselina u njihovim polipeptidnim lanacima. DNK je, 1869., otkrio mladi švicarski kemičar Friedrich Miescher (1844-1895). Skoro stotinu godina kasnije, 1953., američki biolog James Dewey Watson (1928-) i engleski fizičar Francis Harry Compton Crick (1916–2004) otkrili su da se molekula DNK sastoji iz dva komplementarna lanca nukleotida koji se spiralno uvijaju jedan oko drugog i povezani su vodikovim vezama.
DNA se sastoji od dušičnih baza purina i pirimidina, šećera s pet ugljikovih atoma, dezoksiriboze i fosfata. Postoje četiri vrste dušičnih baza: adenin (A), gvanin (G), timin (T) i citozin (C). Preko tih baza vodikovim vezama su povezana dva lanca, pri čemu se uvijek vežu adenin i timin odnosno citozin i guanin. Redoslijed baza u jednom lancu u potpunosti ovisi od redoslijeda baza u drugom, komplementarnom lancu. Ovo svojstvo je od velikog značaja prilikom diobe stanice i prenošenja nasljednog materijala. Promjer uzvojnice je 2 nm, razmak između susjednih baza je 0.34 nm a međusobno su zakrenute za 36° te se tako spiralna struktura ponavlja nakon svakih deset nukleotida (duljina jednog zavoja je 3.4 nm).
destilirana voda → distilled water
Destilirana voda (lat. destillare - kapati) dobiva se kondenzacijom vodene pare tako da ne sadrži otopljenih čvrstih tvari. Upotrebljava se kao otapalo u farmaciji i kemiji. Destilirana voda u ravnoteži je s ugljikovim dioksidom iz zraka i ima vodljivost oko 0.8×10-6 S cm-1. Ponovljenom destilacijom u vakuukmu može se postići vodljivost od 0.043×10-6 S cm-1 pri 18 °C. Ova granična vodljivost uzrokovana je ionizacijom vode
elektroda prvog reda → electrode of the first kind
Elektrode prvog reda jesu metalne elektrode uronjene u otopinu vlastitih iona (npr. srebro uronjeno u otopinu srebrova nitrata). Ravnotežni potencijal je funkcija koncentracije (točnije aktiviteta) metalnih kationa u otopini (vidi Nernstova jednadžba za elektrodni potencijal).
konstanta disocijacije → dissociation constant
Konstanta disocijacije je konstanta čija brojčana vrijednost daje odnos ravnotežnih koncentracija nedisociranog i disociranog oblika molekule. Što je konstanta disocijacije veća, to je više molekula disociralo.
Izraz disocijacija upotrebljava se i za reakcije ionizacije kiselina i baza u vodi. Primjerice, reakcija
često se piše kao disocijacija kiseline na ione
Konstanta ravnoteže za ovakvu reakciju naziva se konstanta disocijacije kiseline (Ka).
Koncentracija vode [H2O] toliko je velika da se može smatrati konstantnom.
Slično tome, može se i ionizacija baze u vodi napisati kao
Konstanta disocijacije baze dana je s
Ka (Kb) je mjera za jakost kiseline (baze).
elektroda drugog reda → electrode of the second kind
Elektrode drugog reda jesu metalne elektrode kojima je ravnotežni potencijal funkcija koncentracije aniona u otopini. Primjer su srebro/srebrov klorid i kalomelova elektroda. U obiju je elektroda metal prekriven svojom teško topljivom soli i uronjen u otopinu koja sadrži isti anion kao i teško topljiva sol. Na taj način je koncentracija kationa metala, odnosno elektrodni potencijal, određena koncentracijom aniona preko produkta topljivosti teško topljive soli.
elektroda trećeg reda → electrode of the third kind
Elektrode trećeg reda jesu metalne elektrode kojima je elektrodni potencijal funkcija koncentracije nekog drugog kationa, ali ne kationa metala od kojeg je elektroda. U ovom slučaju metal je u kontaktu s dvije teško topljive soli (jedna ima kation metala elektrode, a druga ima kation kojemu trebamo odrediti koncentraciju, a obje soli imaju isti anion) uronjene u otopinu soli drugog metala (npr. cink--cinkov oksalat--kalcijev oksalat-- otopina kalcijeve soli). Potencijal ove elektrode ovisi o koncentraciji njenog kationa u otopini, ali njegova je koncentracija kontrolirana koncentracijom aniona preko produkta topljivosti. Koncentracija zajedničkog aniona opet je u ovisnosti o koncentraciji kationa druge teško topljive soli. Ove su elektrode vrlo trome i nestabilne što je posljedica serije ravnoteža koje se moraju uspostavit prije nego što se dobije stabilni potencijal.
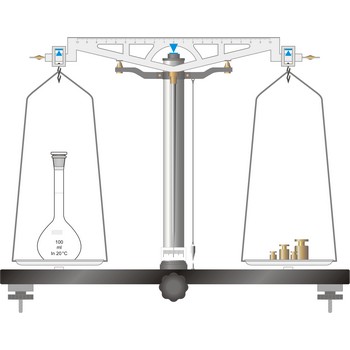
vaga s jednakim krakovima → equal-arm balance
Vaga s jednakim krakovima najjednostavniji je tip vage koji se temelji na principu poluge. Uporište (oslonac) oko koje se okreće poluga vage oštri je brid trostrane ahatne prizme koji se oslanja na ravnu pločicu od istog materijala. Na krajevima poluge, jednako udaljene od uporišta, na prizme noževe obješene su zdjelice. Točnost ove podjele, međusobni položaj prizmi i preciznost njihove obrade određuju kvalitetu vage. Na polugu vage, pod pravim kutom, učvršćena je kazaljka koja pokazuje je li vaga u ravnoteži.
Svaka vaga ima uređaj za kočenje/oslobađanje koji štiti osjetljive bridove prizmi od oštećenje, pogotovo u trenutku stavljanja i skidanja predmeta i utega s vage. Predmet koji se važe stavlja s na zdjelicu obješenu o jedan krak vage (obično lijevu) a odgovarajuća masa utega na zdjelicu obješenu o drugi krak vage. Vaga obavezno mora biti zakočena kada se predmeti ili utezi stavljaju na zdjelice.
Erlenmeyerova tikvica → Erlenmeyer flask
Erlenmeyerova tikvica je staklena posuda konusnog oblika s dugim vratom i ravnim dnom. Ime je dobila po svom izumitelju, njemačkom kemičaru Richardu Erlenmeyeru (1825.-1909.). Zbog oblika tikvice mala je opasnost od gubljenja otopine uslijed prskanja tijekom titracije ili zagrijavanja.
freon → freon
Freoni ili CFC (chlorofluorocarbon) sintetički su spojevi sastavljeni od ugljika, klora i fluora te imaju široku primjenu. Nalazimo ih u rashladnim sustavima hladnjaka i zamrzivača, u sprejevima i tekućinama za čišćenje, a upotrebljavaju se i kao "potisno sredstvo" pomoću kojih se prave pjenasti materijali (stiropor). Oslobađaju atome klora s neparnim brojem elektrona, a oni nastaju cijepanjem molekula uz pomoć sunčeve radijacije valne duljine manje od 450 nm. Sunčevo zračenje daje energiju za cijepanje molekula klora na vrlo aktivne atome klora. Naglo oslobođeni aktivni klor, koji se u obliku molekula nakupljao cijele zime, tj. pod uvjetima niske temperature i smanjene količine sunčeve energije, počinje uništavati molekule ozona. To se događa tako dugo dok se ne "isprazne zalihe" nagomilanog klora, što obično traje oko 6 tjedana. Ako u atmosferu dospije više atoma klora posredstvom freona, onda se to razdoblje produži. Nakon toga uspostavlja se prirodna ravnoteža izgradnje i razgradnje ozona. Inače, freoni nisu aktivni u donjoj atmosferi.
Citiranje ove stranice:
Generalić, Eni. "Ravni lanac." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav