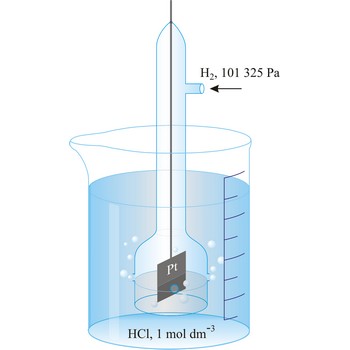
standardna vodikova elektroda → standard hydrogen electrode
Standardna vodikova elektroda sastoji se od elektrode od spužvaste platine uronjene u otopinu vodikovih iona aktiviteta 1 kroz koju se propušta plinoviti vodik pod tlakom od 101 325 Pa. Standardna vodikova elektroda u članku dogovorno se prikazuje uvijek lijevo
Redoks-potencijal standardne vodikove elektrode, pri svim temperaturama, dogovorno je uzet kao 0.
sumpor → sulfur
Sumpor je poznat od davnih vremena. Ime mu potječe od sanskrtskog sulva-ari što znači neprijatelj bakra. To je žuti kristaličan ili amorfan prah bez okusa i mirisa koji se ne otapa u vodi ali se otapa u ugljikovom disulfidu (CS2). Sumpor na zraku gori plavičastim plamenom. Osim u elementarnom stanju sumpor se u prirodi pojavljuje u obliku sulfida i sulfata. Od sulfidnih minerali najčešći su pirit (FeS2), halkopirit (CuFeS2) i sfalerit (ZnS), a od sulfatnih gips (CaSO4·2H2O). Upotrebljava se za proizvodnju sulfatne kiseline, vulkanizaciju gume i proizvodnju baruta.
superkritični ugljikov dioksid → supercritical carbon dioxide
Superkritični ugljikov dioksid (scCO2) moćno je, jeftino, netoksično i ekološki prihvatljivo otapalo. Kada se upotrebljava u superkritičnom stanju (iznad 74 bar i 31 °C) ima sličan otapajući potencijal kao i njegovi organski suparnici, ugljikovodici i klorirana otapala. Superkritični ugljikov dioksid je jedno od rijetkih otapala koje se može bez ograničenja upotrebljavati u prehrambenoj industriji.
termokemijska jednadžba → thermochemical equation
Termokemijska jednadžba je kompaktna jednadžba koja prikazuje i stehiometrijske koeficijente i količinu energije razvijenu ili utrošenu u toj reakciji.
Gornja jednadžba kaže da se za svaki mol plinovitog metana koji izgori u dva mola kisika, nastane jedan mol ugljikova dioksida i dva mola vodene pare te se oslobodi 2 220 kJ topline.
van der Waalsova jednadžba → van der Waals’ equation
Van der Waalsova jednadžba jest jednadžba stanja za realne plinove koja ima oblik:
gdje je P tlak, Vm je molarni volumen, T je temperatura, R je molarna plinska konstanta, a i b su karakteristični parametri tvari koji opisuju učinak privlačnih i odbojnih intermolekularnih sila.
dipolarni ion → zwitterion
Dipolarni ili dvojni ion (zwitterion), poznat i kao unutarnja sol, jest ion koji ima pozitivan i negativan naboj na različitim mjestima iste molekule. Kako ion na sebi istovremeno ima suprotne naboje električki je neutralan. Dipolarni ioni nastaju iz spojeva koji u svojim molekulama imaju i kisele i bazne skupine (amfoliti).
Sve aminokiseline koje se mogu naći u bjelančevinama (proteinima) su amfoliti je sadrže kiselu karboksilnu skupinu (-COOH) i baznu amino skupinu (-NH2). Aminokiseline u čvrstom stanju nalaze se u obliku dipolarnog iona. Dodatkom kiseline u otopinu koja sadrži dipolarne ione aminokiseline karboksilatna skupina prima proton (H+) i aminokiselina postaje pozitivno nabijena. Dodatkom lužine amino skupina gubi proton pri čemu aminokiselina postaje negativno nabijena.
Citiranje ove stranice:
Generalić, Eni. "Plinovito agregatno stanje." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav