električni otpor → resistance
Električni otpor (R) je definiran kao mjera suprotstavljanja prolasku istosmjerne električne struje kroz strujni krug. SI jedinica za električni otpor je ohm, a simbol je grčko slovo omega (Ω). Veliki specifični otpor karakterizira izolatore a mali vodiče. Električni otpor bilo kojeg vodiča ovisi o njegovoj dužini (l), poprečnom presjeku (A) i električnoj otpornosti (ρ).
električna otpornost → resistivity
Električna otpornost (ρ) ili specifični otpor karakteristična je konstanta za svaki materijal. Materijali s niskom otpornošću su dobri vodiči, a s visokom dobri izolatori.
Za vodič jednoličnog profila s površinom A i duljinom L i čiji otpor je R električna otpornost dana je izrazom
Jedinica za električnu otpornost jest Ω m.
reverzibilan proces → reversible process
Reverzibilan proces ili reakcija takav je proces koji se može odvijati u obrnutom smjeru pomoću infinitezimalno male promjene u uvjetima. Npr. voda i led postoje zajedno pri temperaturi od 0 °C i tlaku od 101 325 Pa. Malo povišenje temperature uzrokuje topljenje leda, isto tako malo smanjenje temperature uzrokuje zamrzavanje vode. Otapanje ili zamrzavanje pri ovim uvjetima može se smatrati reverzibilnim.
renij → rhenium
Renij su 1925. godine otkrili Walter Noddack, Ida Tacke i Otto Berg (Njemačka). Ime je dobio od latinskog naziva za rijeku Rajnu - Rhenus. Mendeljejev ga je predvidio 1871. i dao mu ime dvimangan. To je srebrno-bijeli metal velike gustoće. Dobiva se kao sivi prah. Potamni kada stoji u vlažnom zraku. Otporan je na koroziju u slanoj vodi i oksidaciju. Topljiv je u nitratnoj i sulfatnoj kiselini ali ne i u kloridnoj. U prirodi se može naći u gadolinitu, molibdenitu, kolumbitu i nekim sulfidnim rudama ali se nigdje na javlja u koncentracijama većim od 50 ppm. Upotrebljava se kao dodatak volframovim i molibdenovim legurama. Re-Mo legura pokazuje supervodljivost na 10 K. Re-W termopar može mjeriti temperature do 2200 °C.
rubidij → rubidium
Rubidij su 1861. godine otkrili Robert Bunsen i Gustav Kirchhoff (Njemačka). Ime je dobio prema latinskoj riječi rubidus što znači tamnocrven. To je veoma mekani metal sa sjajnom, srebrno bijelom površinom kada je svježa. Brzo potamni na zraku. Burno reagira s vodom a na zraku izgara do superoksida (RbO2). Obično se nalazi uz ostale alkalijske metale pa se dobiva kao nusprodukt pri proizvodnji kalija iz karnalita. Koristi se za proizvodnju fotoelektričnih ćelija.
rutenij → ruthenium
Rutenij je 1844. godine otkrio Karl Karlovich Klaus (Rusija). Ime je dobio od latinskog naziva za Rusiju - Rutenia. To je sjajni i tvrdi srebrni metal koji zajedno s rodijem i paladijem čini skupinu lakih platinskih metala. Stabilan je na zraku, u vodi i kiselinama ali reagira s talinama alkalija. Rutenijev(VIII) oksid je lako hlapljiv i jako toksičan. Pare RuO4 naročito oštećuju sluznicu oka. U prirodi se pojavljuje obično kao pratitelj bakarnih i nikalnih ruda, a poznata je i prirodna legura osmija i iridija koja sadrži rutenij. Upotrebljava se za legiranje platine i paladija (povećava im tvrdoću).
salinitet → salinity
Salinitet (S) je mjera za količinu otopljenih soli u morskoj vodi. Salinitet je definiran kao ukupna količina otopljenih soli u morskoj vodi u promilima, ‰, (djelovima na tisuću) kada se svi karbonati pretvore u okside, bromidi i jodidi u kloride i kada se sve organske tvari kompletno oksidiraju.
Klorinitet je najstarija metoda za mjerenje saliniteta koja, temeljem ideje o stalnom omjeru otopljenih komponenti morske vode, pruža uvid u ukupnu količinu otopljenih soli u morskoj vodi mjerenjem koncentracije halida (klorida, bromida i jodida). Odnos između kloriniteta (Cl) i saliniteta dan u Knudsenovim tablicama jest
Ova formula koristila se do 1962., kada je JPOTS (Joint Panel for Oceanographic Tables and Standards) odredilo novu konstantu proporcionalnosti u Knudsenovoj formuli
U međuvremenu, razvoj uređaja za mjerenje električne vodljivosti doveo je do brze, jeftine i precizne metode za određivanja slanosti morske vode. Uveden je Praktični salinitet (SP) kao zamjena za salinitet dobiven mjerenjem kloriniteta. Skala praktičnog saliniteta (Practical Salinity Scale 1978, PSS-78) definirana je preko K15, odnosno odnosa električne vodljivosti uzorka mora pri t68 = 15 °C i tlaku od jedne standardne atmosfere i otopine kalijevog klorida (KCl) u kojoj je maseni udio KCl točno 0.0324356 (32.4356 g KCl otopljeno je u 1 kg otopine) pri istom tlaku i temperaturi.
Praktični salinitet je bezdimenzijska veličina iako mu ponekad (pogrešno) pripisuju jedinicu "psu". U većini slučajeva može se pretpostaviti da su psu i ‰ sinonimi.
Prosječni salinitet morske vode je 35 ‰, što je oko 35 g soli otopljeno u 1 kg morske vode.
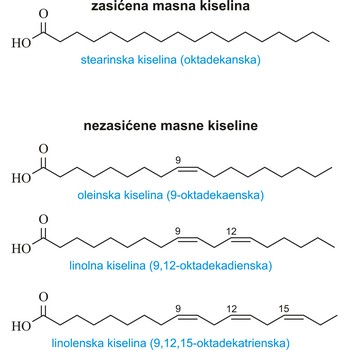
zasićena masna kiselina → saturated fatty acid
Zasićene masne kiseline su kiseline koje imaju maksimalni broj vodikovih atoma vezan za ugljikovodični lanac (nemaju dvostrukih veza između ugljikovih atoma). Najvažnije od njih su:
| maslačna (butanska kiselina) | CH3(CH2)2COOH |
| laurinska (dodekanska kiselina) | CH3(CH2)10COOH |
| miristinska (tetradekanska kiselina) | CH3(CH2)12COOH |
| palmitinska (heksadekanska kiselina) | CH3(CH2)14COOH |
| stearinska (oktadekanska kiselina) | CH3(CH2)16COOH |
| arahinska (eikosanoidna kiselina) | CH3(CH2)18COOH |
skandij → scandium
Skandij je 1879. godine otkrio Lars Fredrik Nilson (Švedska). Ime je dobio prema latinskom nazivu za Skandinaviju - Scandia. Mendeljejev ga je predvidio 1869. i dao mu ime ekaboron. To je mekani, srebrno bijeli metal koji brzo potamni na zraku. Smješta se u skupinu metala rijetkih zemalja skupa s lantanoidima. Burno reagira s vodom stvarajući vodik i netopljivi skandijev hidroksid. Reagira s kisikom iz zraka i halogenima. U prirodi se javlja u lantanoidnim mineralima monacitu i gadolinitu i u rijetkom silikatu thortveititu (Sc2Si2O7). Upotrebljava se u specijalnim živinim lampama i magnezijevim legurama.
more → seawater
More, odnosno morska voda, nezasićena je homogena otopina koja se sastoji od vode kao otapala (96.5 %) i otopljenih soli (3.5 %) te manjih količina partikularne tvari, otopljenih plinova i organskih sastojaka. Veći dio Zemlje pokriven je morskom vodom. Od ukupne površine Zemlje (510 100 000 km2) svjetski oceani prekrivaju skoro 71 % (361 840 000 km2) s prosječnom dubinom od 3 682.2 m.
Gustoća morske vode je, zbog njene slanosti, viša od one čiste vode. Uz to, povećanjem slanosti vode snižava se temperatura ledišta a povisuje temperatura vrelišta mora. Prosječna slanost oceana je 35 ‰, što iznosi oko 35 g čvrste tvari otopljene u 1 kg morske vode. Ispitivanjem koncentracija najzastupljenijih soli u moru utvrđeno je da je njihov relativan odnos u moru konstantan bez obzira na njihovu apsolutnu količinu. Samo šest elemenata i spojeva čine oko 99 % otopljenih soli u moru: klorid (Cl-), natrij (Na+), sulfat (SO42-), magnezij (Mg2+), kalcij (Ca2+) i kalij (K+).
Citiranje ove stranice:
Generalić, Eni. "Omekšivač vode." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav