glikozid → glycoside
Glikozidi su skupina organskih spojeva u kojoj je šećerna skupina (glikon), preko svog anomernog ugljikovog atoma, glikozidnom vezom povezana s nekom drugom skupinom - aglikonom. Prema IUPAC-ovoj definiciji svi disaharidi i polisaharidi su također glikozidi u kojima je aglikon također šećer.
Vodene otopine cikličkih poluacetala ili poluketala šećera spontano uspostavljaju ravnotežu između α i β anomera koji prelaze jedan u drugi preko otvorenog aldehidnog oblika. Međutim, kada se glikozidna veza formira anomerna konfiguracija ostaje zaključana. α i β glikozidi imaju različita kemijska, fizikalna i biološka svojstva.
Naziv glikozid je naknadno proširen tako da obuhvaća ne samo veze između anomernog ugljikovog atoma, i -OR skupine već i njegove veze sa -SR (tioglikozidi) i -SeR (selenoglikozidi). Nazivi N-glikozid (za anomerni C-atom vezan na -NR1R2) i C-glikozid (za anomerni C-atom vezan na -CR1R2R3), iako su široko rasprostranjeni u biokemijskoj literaturi, pogrešni su i ne bi ih se smjelo koristiti.
vrijeme poluraspada → half-life
Za jednostavno radioaktivno raspadanje vrijeme poluraspada, t1/2, definirano je kao vrijeme potrebno da se aktivnost nekog radioaktivnog izotopa smanji na polovicu svoje prvobitne vrijednosti.
Što je brzina raspada veća, to je vrijeme poluraspada manje. Poluživot je karakteristično svojstvo za svaki radioaktivni izotop i neovisno je o početnoj količini radioaktivnog izotopa i uvjetima.
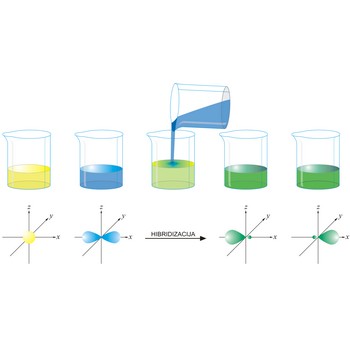
hibridizacija → hybridization
Hibridizacija atomskih orbitala je postupak u kojem se linearnim kombiniranjem valnih funkcija energijski bliskih orbitala stvaraju nove hibridne valne funkcije. Novonastale orbitale su hibridi originalnih i imaju svojstva (oblik, veličinu i energiju) koja se nalaze negdje između svojstava orbitala iz kojih su nastale.
ionski izmjenjivač → ion exchanger
Ionski izmjenjivači su visokopolimerni spojevi koji imaju svojstvo da vežu ione iz otopine, a pri tome oslobađaju ekvivalentnu količinu istoimeno nabijenih iona. Ion izmjenjivačke smole sadrže različite kopolimere čvrsto vezane u trodimenzionalanu strukturu na koju su pričvršćene ionske skupine. Ovisno o strukturi imamo kationske i anionske izmjenjivače. Upotrebljavaju se za prečišćavanje različitih otopina, lijekova, demineraliziranje vode i dr.
kinetička energija → kinetic energy
Kinetička energija (Ek) povezana je sa stanjem gibanja tijela. Ona je skalarno svojstvo i definira se kao umnožak polovice mase i kvadrata brzine:
Doprinos kinetičke energije mnogo je veći kod plinova, čije molekule imaju vrlo veliku slobodu kretanje, nego kod tekućih i čvrstih tvari.
metalno staklo → metallic glass
Određene slitine mogu se, metodom ultrabrzog kaljenja iz taline, skrutnuti u amorfnom obliku, bez formiranja kristalne rešetke - takve, amorfne slitine zovu se metalna stakla.
Primjer su dobivanja metanih stakala cirkonija i nikla. Amorfna Zr2Ni slitina dobiva se metodom ultrabrzog hlađenja, kod koje se indukcijski rastaljena slitina izbacuje tlakom inertnog plina iz kvarcne posude na plohu brzo rotirajućeg valjka. Valjak je napravljen od materijala velike toplinske vodljivosti i na njemu se slitina, zbog velike brzine kojom je izbačena, spreša, naglo ohladi i skrutne. Nakon skrućivanja slitina se od valjka odvaja zbog djelovanja centrifugalne sile. Tako se dobivaju dugačke trake amorfne slitine jednolike širine (~1 mm) i debljine (~1 μm) te poprečnog presjeka kojemu svojstva ovise o brzini hlađenja.
Strukturno svojstvo metalnih stakala jest odsustvo uređenja dugog dosega. Na udaljenostima manjim od 1.5 nm postoje određeni tipovi uređenosti pa ta činjenica ne dozvoljava potpunu usporedbu sa strukturom tekućina, kojoj je svojstvena potpuna neuređenost. Struktura metalnih stakala određuje njihova neobična fizikalna svojstva, sasvim različita od svojstava odgovarajućih kristalnih slitina, a vrlo povoljna za primjene u tehnologiji. Mehaničke osobine (čvrstoća, elastičnost, otpornost na koroziju) čine neka stakla pogodnim za izradu kompozitnih materijala. Slitine prijelaznih metala i rijetkih zemalja mogu imati svojstva između mekih i vrlo tvrdih magneta pa se mogu upotrijebiti kao magnetske memorije. Supravodljivi amorfni metali mogu se koristiti za izradu rotora supravodljivih generatora i motora.
nemetal → non-metal
Nemetali su elementi koji ne pokazuju metalna svojstva (slabi su vodiči topline i električne struje, ne daju se kovati itd.). Njihove se molekule uglavnom sastoje od kovalentno vezanih atoma osim kod idealnih plinova koji su monoatomni.
Smješteni su skroz desno u periodnom sustavu. Oksidi nemetala otapanjem u vodi daju kiseline. Nemetali imaju skoro popunjenu vanjsku ljusku s elektronima i lako se spajaju jedan s drugim ili s metalima. Kod mnogih elemenata ove grupe susrećemo alotropiju.
monosaharid → monosaccharide
Monosaharidi su ugljikohidrati, opće formule Cn(H2O)n, koji se hidrolizom ne mogu rastaviti na jednostavnije ugljikohidrate.
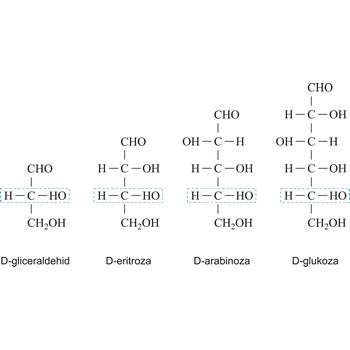
Ovisno o tome sadrže li aldehidnu (RCHO) ili keto skupinu (RCOR’) monosaharidi mogu biti polihidroksi aldehidi ili polihidroksi ketoni. Aldehidna odnosno keto skupina odgovorne su za redukcijska svojstva monosaharida. Monosaharidi se mogu podijeliti i prema broju ugljikovih atoma u ugljikovodičnom lancu pa tako imamo trioze s tri ugljikova atoma, tetroze s četiri, pentoze s pet, heksoze sa šet, heptoze sa sedam itd. Ova dva sustava podjele često se kombiniraju. Primjerice, D-glukoza, polihidroksi aldehid, je aldoheksoza a fruktoza, polihidroksi keton, je ketoheksoza.
Oznake D i L često se koriste da opišu konfiguraciju ugljikohidrata. U Fischerovoj projekcijskoj formuli, karbonilna skupina je uvijek smještena na vrh (u slučaju aldoza) ili što je moguće bliže vrhu (u slučaju ketoza). Ako se OH skupina na asimetričnom ugljikovom atomu najudaljenijem od karbonilne skupine (drugom odozdo) nalazi s desne strane imamo D-šećer, a ako je s lijeve strane, L-šećer. Uz rijetke iznimke svi šećeri u prirodi su D-šećeri.
Otvoreni lanac monosaharida može intramolekularnom ciklizacijom preći u prstenastu strukturu. Ciklizacijom nastaju dva konfiguracijska izomera, točnije dijastereomera (anomera), jer se ciklizacijom planarna karbonilna skupina pretvara u asimetrični ugljikov atom. Anomer kod kojeg je konfiguracija anomernog ugljika ista kao konfiguracija referentnog asimetričnog ugljika u Fischerovoj projekciji označava se kao α-anomer, a ako je konfiguracija različita radi se o β-anomeru.
pravilo okteta → octet rule
Pravilo okteta kaže da se kemijska svojstva elemenata redovito ponavljaju s porastom atomske mase i da su svojstva svakog osmog elementa slična. Budući da svi plemeniti plinovi osim helija imaju po osam elektrona u svojoj vanjskoj ljusci, takva se stabilna elektronska konfiguracija zove pravilo okteta. U kemijskim reakcijama atomi elemenata imaju tendenciju da reagiraju na način da postignu elektronsku konfiguraciju plemenitog plina koji im je najbliži u periodnom sustavu elemenata. Postoji mnogo iznimaka ovog pravila.
Citiranje ove stranice:
Generalić, Eni. "Koligativno svojstvo." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav