dubnij → dubnium
Dubnij su 1967. godine otkrili djelatnici Berkeley Laboratorija (USA) i Nuklearnog istraživačkog centra u Dubni (Rusija) Ime je dobio po ruskom Institutu za nuklearna istraživanja u Dubni. To je sintetski radioaktivni metal. U Dubni su dubnij pripravili bombardiranjem americija-243 jezgrama neona-22, a u Berkeleyu bombardiranjem kalifornija jezgrama dušika-15.
meitnerij → meitnerium
Meitnerij su 1982. godine otkrili Peter Armbruster, Gottfried Münzenber i suradnici iz GSI (Gesellschaft für Schwerionenforschung), Darmstadt (Njemačka). Ime je dobio u čast austrijske fizičarke Lise Meitner (1878.-1968.). To je sintetski radioaktivni metal. Meitnerij je pripravljen bombardiranjem bizmuta-209 jezgrama željeza-58.
mendelevij → mendelevium
Mendelevij su 1955. godine otkrili Albert Ghiorso, Bernard G. Harvey, Gregory R. Choppin, Stanley G. Thompson i Glenn T. Seaborg (USA). Ime je dobio u čast ruskog kemičara Dmitrija Ivanovića Mendeljejeva (1834.-1907.) tvorca periodnog sustava elemenata. To je sintetski radioaktivni metal. Mendelevij nastaje bombardiranjem einsteinija alfa-česticama.
elektroda trećeg reda → electrode of the third kind
Elektrode trećeg reda jesu metalne elektrode kojima je elektrodni potencijal funkcija koncentracije nekog drugog kationa, ali ne kationa metala od kojeg je elektroda. U ovom slučaju metal je u kontaktu s dvije teško topljive soli (jedna ima kation metala elektrode, a druga ima kation kojemu trebamo odrediti koncentraciju, a obje soli imaju isti anion) uronjene u otopinu soli drugog metala (npr. cink--cinkov oksalat--kalcijev oksalat-- otopina kalcijeve soli). Potencijal ove elektrode ovisi o koncentraciji njenog kationa u otopini, ali njegova je koncentracija kontrolirana koncentracijom aniona preko produkta topljivosti. Koncentracija zajedničkog aniona opet je u ovisnosti o koncentraciji kationa druge teško topljive soli. Ove su elektrode vrlo trome i nestabilne što je posljedica serije ravnoteža koje se moraju uspostavit prije nego što se dobije stabilni potencijal.
mineralna voda → mineral water
Mineralne vode su izvorne vode koje sadrže više od 0.1 % otopljenih čvrstih tvari ili imaju temperaturu iznad 20 °C, terme, ili su radioaktivne. Mnoge mineralne vode imaju ljekovita svojstva pa se koriste za piće i kupke.
neptunij → neptunium
Neptunij su 1940. godine otkrili Edwin M. McMillan i P. H. Abelson (USA). Ime je dobio po planetu Neptunu. To je sintetski radioaktivni srebrni metal. Otporan je na alkalije. Reagira s kiselinama, kisikom i vodenom parom. Visoko je radiotoksičan. Neptunij se pripravlja u nuklearnim reaktorima bombardiranjem uranija-238 s neutronima.
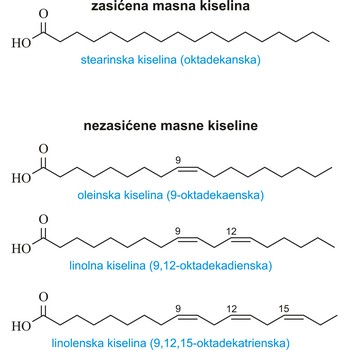
masna kiselina → fatty acid
Masne kiseline jesu alifatske monokarboksilne kiseline koje su karakterizirane terminalnom karboksilnom skupinom (R-COOH). Viši članovi ovog niza pojavljuju se u prirodi u obliku estera glicerola (masti) zbog čega se cijela obitelj ovih spojeva naziva masne kiseline. Prirodne masne kiseline obično su građene od 4 do 28 ugljikovih atoma u lancu (obično imaju paran broj) a mogu biti zasićene i nezasićene. Najvažnije zasićene masne kiseline jesu maslačna (C4), laurinska (C12), palmitinska (C16) i stearinska (C18). Od nezasićenih masnih kiselina najčešće se sreću oleinska, linolna i linolenska (sve imaju 18 ugljikovih atoma u lancu).
Fizikalna svojstva masnih kiselina ovise o dužini lanca, stupnju nezasićenosti i razgranatosti lanca. Kiseline s kratkim lancem jesu tekućine oštrog mirisa topljive u vodi. Porastom dužine lanca talište im raste a topljivost u vodi opada. Nezasićene masne kiseline i one s razgranatim lancem imaju niže talište.
grafit → graphite
Grafit je alotrop ugljika. Dobar je vodič topline i elektriciteta. U grafitu atomi su povezani u heksagonalne prstenove koji su složeni u slojevima. Kako ovi slojevi lako klize jedan preko drugog grafit se često koristi kao kruto mazivo. Sintetski grafit dobiva se zagrijavanjem smjese gline (aluminijeva silikata) i koksa u procesu koji je izumio američki kemičar Edward Goodrich Acheson (1856.–1931.). U reakciji nastaje silicijev karbid koji pri 4150 °C gubi silicij ostavljajući čisti grafit.
vrijeme poluraspada → half-life
Za jednostavno radioaktivno raspadanje vrijeme poluraspada, t1/2, definirano je kao vrijeme potrebno da se aktivnost nekog radioaktivnog izotopa smanji na polovicu svoje prvobitne vrijednosti.
Što je brzina raspada veća, to je vrijeme poluraspada manje. Poluživot je karakteristično svojstvo za svaki radioaktivni izotop i neovisno je o početnoj količini radioaktivnog izotopa i uvjetima.
Citiranje ove stranice:
Generalić, Eni. "Radioactive series." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav