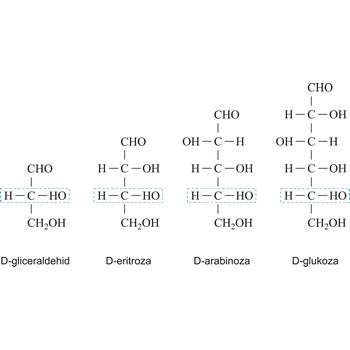
monosaharid → monosaccharide
Monosaharidi su ugljikohidrati, opće formule Cn(H2O)n, koji se hidrolizom ne mogu rastaviti na jednostavnije ugljikohidrate.
Ovisno o tome sadrže li aldehidnu (RCHO) ili keto skupinu (RCOR’) monosaharidi mogu biti polihidroksi aldehidi ili polihidroksi ketoni. Aldehidna odnosno keto skupina odgovorne su za redukcijska svojstva monosaharida. Monosaharidi se mogu podijeliti i prema broju ugljikovih atoma u ugljikovodičnom lancu pa tako imamo trioze s tri ugljikova atoma, tetroze s četiri, pentoze s pet, heksoze sa šet, heptoze sa sedam itd. Ova dva sustava podjele često se kombiniraju. Primjerice, D-glukoza, polihidroksi aldehid, je aldoheksoza a fruktoza, polihidroksi keton, je ketoheksoza.
Oznake D i L često se koriste da opišu konfiguraciju ugljikohidrata. U Fischerovoj projekcijskoj formuli, karbonilna skupina je uvijek smještena na vrh (u slučaju aldoza) ili što je moguće bliže vrhu (u slučaju ketoza). Ako se OH skupina na asimetričnom ugljikovom atomu najudaljenijem od karbonilne skupine (drugom odozdo) nalazi s desne strane imamo D-šećer, a ako je s lijeve strane, L-šećer. Uz rijetke iznimke svi šećeri u prirodi su D-šećeri.
Otvoreni lanac monosaharida može intramolekularnom ciklizacijom preći u prstenastu strukturu. Ciklizacijom nastaju dva konfiguracijska izomera, točnije dijastereomera (anomera), jer se ciklizacijom planarna karbonilna skupina pretvara u asimetrični ugljikov atom. Anomer kod kojeg je konfiguracija anomernog ugljika ista kao konfiguracija referentnog asimetričnog ugljika u Fischerovoj projekciji označava se kao α-anomer, a ako je konfiguracija različita radi se o β-anomeru.
živčani bojni otrov → nerve poison
Živčani su bojni otrovi imali dominantnu ulogu u Drugom svjetskom ratu. Ime im dolazi po tome što utječu na prijenos impulsa u živčanom sustavu. Svi živčani bojni otrovi spadaju u grupu organo-fosfornih spojeva. Stabilni su i lako se raspršuju, vrlo su toksični i imaju brz učinak bilo da se apsorbiraju kroz kožu ili udisanjem. Živčani bojni otrovi mogu se proizvesti prilično jednostavnim kemijskim tehnikama, a sirovine su jeftine i općenito lako dostupne.
Najvažniji živčani bojni otrovi uključeni u moderne arsenale jesu:
| Tabun | (o-etil dimetilamidofosforilcijanid) |
| Sarin | (izopropil metilfosfonofluoridat) |
| Soman | (pinakolil metilfosfonofluoridat) |
| GF | (cikloheksil metilfosfonofluoridat) |
| VX | (o-etil-diizopropilaminometil metilfosfonotiolat) |
Živčani bojni otrovi lako su hlapljive tekućine bez boje, okusa i mirisa. Antidote za njih su atropin sulfat i pralidoksim jodid.
nuklearni reaktor → nuclear reactor
Nuklearni reaktori su postrojenja koja su projektirana za proizvodnju električne energije. Lančana reakcija fisibilnog materijala (uranij-235 ili plutonij-239) provodi se kontinuirano i pod kontrolom. Od sekundarnih neutrona samo jedan jedini smije izazvati daljnje cijepanje.
Osnovni dijelovi nuklearnog reaktora jesu:
- Jezgra, metalne šipke koje sadrže dovoljno fisibilnog materijala da održe lančanu reakciju na željenom nivou (može biti potrebno i preko 50 t uranija).
- Izvor neutrona koji će pokrenuti reakciju (kao što je mješavina polonija i berilija)
- Moderator koji će smanjiti energiju brzih neutrona za učinkovitiju fisiju (materijali kao što su grafit, berilij, teška voda i laka voda)
- Sredstvo za hlađenje kojim se uklanja fisijom stvorena toplina (obično voda, natrij, helij ili dušik)
- Sustav kontrole kao što su primjerice šipke bora ili kadmija koji imaju visoki udarni profil (da apsorbiraju neutrone)
- Adekvatna zaštita, kontrolna oprema i odgovarajuća instrumentacija neophodna za sigurnost osoblja i učinkoviti rad.
kvalitativna analiza → qualitative analysis
Kvalitativna analiza obuhvaća metode razdvajanja i dokazivanja kojima utvrđujemo od kojih je kemijskih elemenata ili spojeva sastavljena neka tvar. Kvalitativna anorganska analiza koristi se za određivanje kationa i aniona u otopini uzorka. Kationi su podijeljeni u šest skupina ovisno o topljivosti njihovih taloga sa skupnim reagensom.
more → seawater
More, odnosno morska voda, nezasićena je homogena otopina koja se sastoji od vode kao otapala (96.5 %) i otopljenih soli (3.5 %) te manjih količina partikularne tvari, otopljenih plinova i organskih sastojaka. Veći dio Zemlje pokriven je morskom vodom. Od ukupne površine Zemlje (510 100 000 km2) svjetski oceani prekrivaju skoro 71 % (361 840 000 km2) s prosječnom dubinom od 3 682.2 m.
Gustoća morske vode je, zbog njene slanosti, viša od one čiste vode. Uz to, povećanjem slanosti vode snižava se temperatura ledišta a povisuje temperatura vrelišta mora. Prosječna slanost oceana je 35 ‰, što iznosi oko 35 g čvrste tvari otopljene u 1 kg morske vode. Ispitivanjem koncentracija najzastupljenijih soli u moru utvrđeno je da je njihov relativan odnos u moru konstantan bez obzira na njihovu apsolutnu količinu. Samo šest elemenata i spojeva čine oko 99 % otopljenih soli u moru: klorid (Cl-), natrij (Na+), sulfat (SO42-), magnezij (Mg2+), kalcij (Ca2+) i kalij (K+).
jednostavna kubična rešetka → simple cubic lattice
Jednostavna ili primitivna kubična rešetka (označava se sa sc ili P) ima po jedan čvor kristalne rešetke u svakom uglu jedinične ćelije. Kristalografski vektori jedinične ćelije su a = b = c a kutovi među njima α=β=γ=90°.
Najjednostavnija kristalna struktura jeste ona koja ima po jedan atom u svakom čvoru jedinične ćelije. Jediničnoj ćeliji pripada jedan atom (8×1/8 = 1), a atomi popunjavaju 52 % volumena kocke. Samo jedan metal (α-polonium) kristalizira u kubičnom sustavu s jednostavnom rešetkom.
spin → spin
Spin je unutrašnji kinetički moment osnovne čestice, ili sustava čestica kao što je npr. jezgra. Također je odgovoran za magnetski moment čestice. Spinovi jezgara imaju karakteristične fiksne vrijednosti. Parovi neutrona i protona poredaju se tako da se njihovi spinovi ponište, tako da će jezgre s neparnim brojem neutrona i/ili protona imati kvantni nuklearni spinski broj različit od nule.
Stern-Gerlachov su 1921. ustanovili da se utjecajem nehomogenoga magnetskog polja na mlaz atoma srebra ovaj cijepa u dva snopa, jedan paralelan a drugi antiparalelan magnetskom polju.
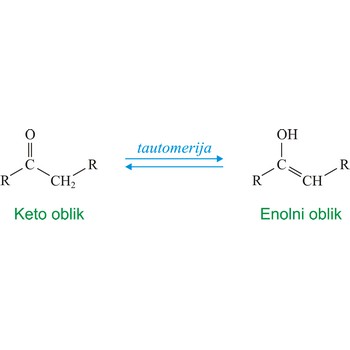
tautomerija → tautomerism
Tautomerija je izraz koji se odnosi na ravnotežu dviju različitih struktura istog spoja. Obično se tautomeri razlikuju u mjestu spajanja vodikovog atoma. Najčešći primjer tautomernog sustava je ravnoteža između ketona (keto) i aldehida (enol).
Heyrovsky-Ilkovičeva jednadžba → Heyrovsky-Ilkovic equation
U polarografiji, Heyrovsky-Ilkovičeva jednadžba opisuje krivulju ovisnosti jakosti struje o potencijalu (polarografski val) reverzibilnih redoks sustava
gdje je R opća plinska konstanta, T je apsolutna temperatura, F je Faradayeva konstanta, n je broj elektrona izmijenjenih u elektrodnoj reakciji a D i D1 su koeficijenti difuzije. E1/2 je potencijal karakterističan za danu reakciju i osnovni elektrolit (poluvalni potencijal).
Kako bi dobili E1/2 iz gornje jednadžbe nacrtat ćemo graf ovisnosti ln[(id-i)/i] o potencijalu. Vrijednost E1/2 očita se iz grafa u točki u kojoj pravac siječe ordinatu. Ako su procesi na elektrodi reverzibilni iz nagiba pravca (nF/RT) može se izračunati broj izmijenjenih elektrona, n.
apsorbancija → absorbance
Apsorbancija (A) je logaritam omjera intenziteta upadnog zračenja (Po) i propuštenog zračenja (P) kroz uzorak (izuzimajući efekte posude u kojoj je uzorak).
Apsorpcija svjetlosti kroz otopine može se matematički opisati Beer-Lambertovim zakonom
gdje je A apsorbancija na danoj valnoj duljini svjetlosti, ε je molarni apsorpcijski (ekstinkcijski) koeficijent (L mol-1 cm-1), svojstven svakoj molekulskoj vrsti i ovisan o valnoj duljini svjetlosti, b je duljina puta svjetlosti kroz uzorak (cm) a c je koncentracija tvari u otopini (mol L-1).
Citiranje ove stranice:
Generalić, Eni. "Periodni_sustav_elemenata." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav