zakon o kemijskoj ravnoteži → law of chemical equilibrium
Zakon o kemijskoj ravnoteži kaže da je brzina kojom neka tvar reagira proporcionalna njenoj aktivnoj masi (molarnoj koncentraciji). Tako je brzina kemijske reakcije proporcionalna umnošku koncentracija reaktanata.
Gibbsov zakon faza → Gibbs phase rule
Gibbsov zakon faza određuje broj faza termodinamičkog sustava u ravnoteži. Dan je izrazom
gdje je C broj komponenti smjese, P je broj faza a F broj stupnjeva slobode, tj. broj neovisnih varijabli koje se mogu promijeniti a da se ne promijeni broj faza.
nulti zakon termodinamike → zero law of thermodynamics
Nulti zakon termodinamike glasi: Ako je neko tijelo A u toplinskoj ravnoteži s tijelom B i s tijelom C, onda su i tijela B i C u međusobnoj toplinskoj ravnoteži.
Hookeov zakon → Hooke’s law
Hookeov zakon kaže da je deformacija tijela proporcionalna primijenjenoj sili pod uvjetom da se ne prijeđe granica elastičnosti tijela. Kada se sila ukloni tijelo će se vratiti u svoj prvobitni oblik. Zakon je otkrio engleski fizičar Robert Hook 1676.
Ako se tijelo na elastičnoj opruzi pomakne iz ravnotežnog položaja, tj. ako se opruga rastegne ili stisne, djelovat će povratna sila (elastična sila opruge), koja će nastojati tijelo vratiti u ravnotežni položaj. Iznos te sile je proporcionalan pomaku tijela iz ravnotežnog položaja. Dakle, ako je pomak x, povratna sila je:
a koeficijent proporcionalnosti k je konstanta opruge (ovisi o njenim dimenzijama, obliku i materijalu od kojega je izrađena).
Hessov zakon → Hesse’s law
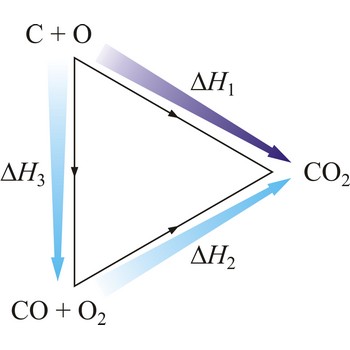
Zakonitost termokemijskih pojava otkrio je 1840. ruski kemičar švicarskog porijekla Germain Henri Hess (1802.-1850.). Njegov zakon glasi: Reakcijska toplina neke kemijske promjene ne ovisi o putu kojim reakciju vodimo, već samo o početnom i konačnom stanju sustava. Hessov zakon poznat je i kao zakon o stalnosti zbroja toplina reakcije.
Na primjer, eksperimentalno je određena entalpija oksidacije grafita u ugljikov dioksid i ugljikova monoksida u ugljikov dioksid. Zbog ravnoteže
nije moguće odrediti entalpiju oksidacije grafita u ugljikov monoksid. Međutim, reakcijska toplina te reakcije može se izračunati primjenom Hessovog zakona.
| C(s) + O2(g) →← CO2(g) | ΔrH1 = -393 kJ mol-1 |
| CO(g) + 1/2O2(g) →← CO2(g) | ΔrH2 = -283 kJ mol-1 |
| C(s) + 1/2O2(g) →← CO(g) | ΔrH3 = -110 kJ mol-1 |
zakon o očuvanju mase → law of conservation of mass
Zakon o očuvanju mase kaže da se nikakav vidljiv gubitak ni dobitak mase ne može otkriti tijekom kemijske reakcije. Stanje tvari može se promijeniti u kemijskoj reakciji, npr. iz čvrstog u plinovito, ali se ukupna masa neće promijeniti. Energija koja se oslobodi ili adsorbira tijekom kemijske reakcije rezultat je prijenosa energije između atoma i njihove okoline.
Ostwaldov zakon razrjeđenja → Ostwald’s dilution law
Ostwaldov zakon razrjeđenja izraz je za ovisnost molarne provodnosti Λ otopine elektrolita o koncentraciji. To se može napisati kao jednadžba pravca
gdje je c koncentracija, Kc je koncentracijska konstanta ravnoteže, i Λ0 je provodnost kod cΛ = 0. Iz podataka za molarnu provodnost pri raznim koncentracijama može se iz odsječka odrediti Λ0 a iz nagiba pravca Kc. Ovaj zakon je prvi iznio njemački kemičar Wilhelm Ostwald (1853.-1932.).
Avogadrov zakon → Avogadro’s law
Avogadrov zakon važi za idealne plinove. Kaže da jednaki volumeni različitih plinova sadrže jednaki broj molekula pri istom tlaku i temperaturi. Postavio ga je 1811. talijanski kemičar Amadeo Avogadro (1776.-1856.).
Beerov zakon → Beer’s law
Beerov zakon (naziva se i Beer-Lambertov zakon) daje funkcijski odnos između veličine mjerene apsorpcijskom metodom (A) i veličine koja se određuje, koncentracije (c). Posljedica međudjelovanja fotona i čestica koje apsorbiraju jest smanjenje snage snopa s Po na P. Beerov zakon može se prikazati kao
gdje je A apsorbancija na danoj valnoj duljini svjetlosti, ε je molarni apsorpcijski (ekstinkcijski) koeficijent (L mol-1 cm-1), svojstven svakoj molekulskoj vrsti i ovisan o valnoj duljini svjetlosti, b je duljina puta svjetlosti kroz uzorak (cm) a c je koncentracija tvari u otopini (mol L-1).
Biot-Savartov zakon → Biot-Savart law
Magnetsko polje B vodiča kojim teče struja može se odrediti uz pomoć Biot-Savartovog zakona. Doprinos magnetskom polju na udaljenosti r od strujnog elementa IdL dan je izrazom:
u kojem je μ0 permeabilnost. Uloga permeabilnosti u magnetostatici vrlo je slična ulozi permitivnosti u elektrostatici. Da bi se odredilo ukupno magnetsko polje B (doprinos cijelog vodiča), potrebno je integrirati doprinose svih strujnih elemenata duž vodiča. Za magnetsko polje dugog ravnog vodiča kojim teče struja I, Biot-Savartov zakon daje sljedeći izraz:
SI jedinica za magnetsko polje je tesla (T).
Permeabilnost μ0 ima vrijednost 4π×10-7 T m A-1.
Citiranje ove stranice:
Generalić, Eni. "Zakon o kemijskoj ravnoteži." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav