Mohrova sol → Mohr’s salt
Mohrova sol je trivijalno ime za dvostruku sol željezov(II) amonijev sulfat heksahidrat, [Fe(NH4)2 (SO4)2·6H2O].
monodentantni ligand → monodentate ligand
Monodentantan je onaj ligand koji ima samo jedan atom koji se veže na centralni atom u kompleksu, npr. amonijak i kloridni ion su monodentantni ligandi bakra u kompleksima [Cu(NH3)6]2+ i [CuCl6]2+.
mukopolisaharid → mucopolysaccharide
Mukopolisaharidi su ugljikohidrati koji se nalaze u staničnim stjenkama bakterija.
boca ispiralica → gas washing bottle
Boca ispiralica (boca za pranje plinova ili Drechselova boca) omogućava jeftin ali učinkovit način za pranje i sušenje plinova. Plin u bocu ulazi kroz središnju vertikalnu dovodnu cijev čiji se vrh nalazi ispod površine medija za pranje (sušenje). Dovodna cijev na svom kraju može imati pločicu od sinteriranog stakla koja smanjuje veličinu mjehurića, čime se povećava kontaktna površina između plina i tekućine. Mjehurići plina prolaze kroz medij i izlaze kroz bočnu cijev koja se nalazi na vrhu boce. Ime je dobila po njemačkom kemičaru Edmundu Drechselu (1843.-1897.).
germanij → germanium
Germanij je 1886. godine otkrio Clemens Winkler (Njemačka). Ime je dobio po latinskom nazivu za Njemačku - Germania. Mendeljejev ga je predvidio 1871. i dao mu ime ekasilicij. To je srebrno bijeli, krti polumetal. Ne reagira s razrijeđenim lužinama i većinom kiselina, osim koncentrirane nitratne i sulfatne kiseline. Stabilan je u zraku i vodi. Burno reagira s oksidansima. Germanij se u prirodi nalazi u malim koncentracijama u obliku argirodita (4Ag2S·GeS2) i germanita (7CuS·FeS·GeS2). Upotrebljava se u elektronici za proizvodnju poluvodiča, i u proizvodnji staklenih leća.
Gibbsov zakon faza → Gibbs phase rule
Gibbsov zakon faza određuje broj faza termodinamičkog sustava u ravnoteži. Dan je izrazom
gdje je C broj komponenti smjese, P je broj faza a F broj stupnjeva slobode, tj. broj neovisnih varijabli koje se mogu promijeniti a da se ne promijeni broj faza.
globalno zatopljenje → global warming
Globalno zatopljenje ili efekt staklenika pojava je koja se zbiva u atmosferi zbog prisustva određenih plinova koji apsorbiraju infracrveno zračenje. Vidljive i ultraljubičaste zrake sposobne su prodrijeti kroz atmosferu i zagrijati Zemljinu površinu. Ovu energiju Zemlja reemitira kao infracrveno zračenje, koje zbog veće valne duljine biva apsorbirano od strane ugljikova dioksida. Posljedica toga je povećanje srednje temperature Zemlje i njene atmosfere (globalno zatopljenje). Slično se dešava i u stakleniku gdje svjetlost i duže ultraljubičaste zrake mogu proći kroz staklo ali infracrvenu radijaciju staklo apsorbira i dio reemitira u staklenik.
Ova pojava se smatra velikim rizikom i opasnošću za okoliš. Prosječno povećanje temperature može promjeniti klimu te može dovesti do otapanja ledenih polarnih kapa, a onda bi porast razine mora mogao imati katastrofične posljedice. Pokraj ugljikova dioksida, koji nastaje sagorijevanjem fosilnih goriva, negativan utjecaj na atmosferu imaju dušikovi oksidi, ozon, metan i klorofluorougljici.
glukoza → glucose
Glukoza (grožđani šećer, krvni šećer) ugljikohidrat je iz skupine monosaharida ili jednostavnih šećera kemijske formule C6H12O6. Stari naziv dekstroza potječe od toga što glukoza zakreće ravninu polarizirane svjetlosti u desno. Prema broju ugljikovih atoma u svojoj molekuli glukoza je heksoza, a prema funkcionalnoj skupini aldoza (aldoheksoza). Glukoza je najrasprostranjeniji šećer u prirodi. Slobodna se nalazi u raznom voću i medu a vezana u disaharidima (saharozi, maltozi, laktozi), polisaharidima (škrobu, glikogenu, celulozi) i raznim drugim spojevima. Kod čovjeka se može naći slobodna u krvi ili kao rezerva pohranjena u jetri i mišićima u obliku glikogena.
Glukozu sintetiziraju biljke procesom fotosinteze i pohranjuju u polimernom obliku kao škrob. U probavnom sustavu škrob se hidrolizira u glukozu koja se zatim iskorištava u stanicama za dobivanje energije. Ukupno se iz jedne molekule glukoze može dobiti 36 molekula ATP-a.
Zbog tetraedarskih kutova koje čine veze među ugljikovim atomima, molekula glukoze može zauzeti takvu konformaciju da hidroksilna skupina vezana na petom ugljikovom reagira s karbonilnom skupinom pri čemu nastaje poluacetal, odnosno šesteročlani heterociklički prsten. Time se javlja još jedan asimetrični centar na atomu C-1, tako da D-glukoza može postojati u dva oblika, kao α-D-glukopiranoza i β-D-glukopiranoza. Ta su dva ciklička oblika u ravnoteži, tj. oni mogu preći jedan u drugog preko aldehidnog oblika.
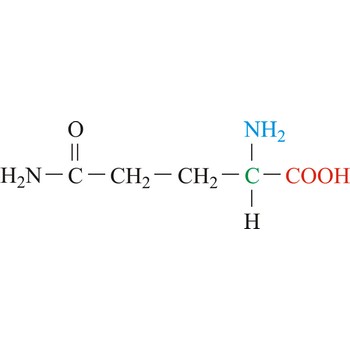
glutamin → glutamine
Glutamin je neutralna aminokiselina s polarnim pobočnim lancem. On je važni nositelj amonijaka i sudjeluje u sintezi uree. Važan je prekursor za sintezu purina i pirimidina. Glutamin ne spada u esencijalne aminokiseline ali to može postati u izvanredni situacijama, primjerice kod intenzivnih treninga, opeklina ili bolesti probanog sustava. Sintetizira se iz glutamata i amonijaka u prisutnosti enzima glutamin sintetaze.
- Kratice: Gln, Q
- IUPAC ime: 2,5-diamino-5-oksopentanska kiselina
- Molekularna formula: C5H10N2O3
- Molekularna masa: 146.14 g/mol
Citiranje ove stranice:
Generalić, Eni. "Sửa báo cáo khoản vay nước ngoài." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav