mjerodavni reaktant → limiting reactant
Mjerodavni reaktant je reaktant u kemijskoj reakciji koji ograničava količinu proizvoda koji može nastati. Reakcija će stati kada sav limitirajući reagens proreagira. Svi ostali reaktanti su prisutni u suvišku.
poluživot reaktanta → half-life of a reactant
Za danu reakciju poluživot, t1/2, reaktanta jest vrijeme potrebno da njegova koncentracija dosegne vrijednost koja je aritmetička sredina njegove početne i konačne (ravnotežne) vrijednosti.
Poluživot reaktanta konstantan je za reakcije prvog reda.
Poluživot reaktanta za reakcije drugog reda nije konstantan već ovisi, osim o konstanti k, i o početnoj koncentraciji reaktanta.
aktivirani kompleks → activated complex
Aktivirani kompleks je intermedijerna struktura prilikom pretvorbe reaktanata u produkte. Nastaje pri maksimalnom energetskom sadržaju duž reakcijske staze. Energija aktivacije je razlika između energije aktiviranog kompleksa i energije reaktanata.
energija aktivacije → activation energy
Energija aktivacije ili energija aktiviranja reakcije (Ea) energija je koju je potrebno dovesti molekulama da međusobno reagiraju. Da bi molekule kemijski reagirale, moraju se sudariti, ali međusobno mogu reagirati samo one molekule koje imaju veću energiju od energije aktiviranja. U kemijskoj kinetici energija aktivacije je visina potencijalne barijere koja odvaja produkte od reaktanata. Što je energija aktivacije veća, to manji broj molekula može prijeći vrh energetske barijere i reakcija je sporija.
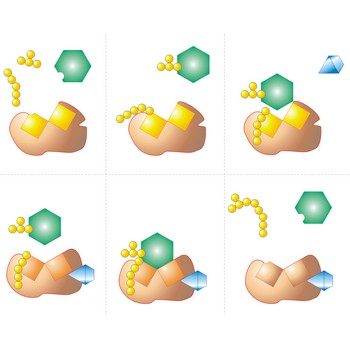
aktivno mjesto → active site
Aktivno mjesto je džep, odnosno udubina na enzimskoj molekuli koja odgovara molekuli reaktanta kao ruka rukavici. Aktivno mjesto smanjuje energiju aktivacije dotične reakcije.
reakcije adicije → addition reactions
Reakcije adicije obično se pojavljuju kod nezasićenih spojeva i uključuju adiciju jedne molekule (reaktanta) preko nezasićene veze (npr. dvostruka ili trostruka veza) na drugu molekule (supstrata) čime se dobije jedinstven produkt koji je formiran kombinacijom obadviju reagirajućih molekula.
Npr. adicija broma preko dvostruke veze etena u reakciji adicije da nastane dibrometan.
prosječna brzina reakcije → average rate of reaction
Prosječna brzina reakcije izračunava se tako da se ukupna promjena u koncentraciji reaktanata i produkata podijeli s vremenom koje je potrebno da bi reakcija završila.
kemijska ravnoteža → chemical balance
Kemijska ravnoteža je stupanj reverzibilne reakcije u zatvorenom sustavu kad se napredna i povratna reakcija događaju istom brzinom, a njihovi se učinci međusobno poništavaju, dok se koncentracije reaktanata i produkata ne mijenjaju.
izjednačavanje kemijske jednadžbe → chemical equation equalization
Izjednačavanje kemijske jednadžbe je određivanje vrijednosti stehiometrijskih koeficijenata reaktanata i produkata u kemijskoj jednadžbi na način da broj atoma svakog elementa bude jednak prije i poslije reakcije.
Citiranje ove stranice:
Generalić, Eni. "Reaktant." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav