periodni sustav elemenata → periodic table of the elements
Periodni sustav elemenata jest tablica u kojoj su svi elementi složeni na temelju fizičkih i kemijskih svojstava. Elementi su svrstani u 18 vertikalnih skupina i 7 horizontalnih perioda. Svaka skupina (kolona tablice) sadrži elemente koji imaju slična svojstva. Broj koji određuje položaj elementa u periodnom sustavu, odnosno vrstu atoma, naziva se redni ili atomski broj. Svojstva elemenata periodična su funkcija njihovog rastućeg atomskog broja. Originalna tablica, koju je predstavio 1869. ruski kemičar D. I. Mendeljejev (1834.-1907.), bila je složena po rastućim atomskim masama (uz neke iznimke).
polimorfija → polymorphism
Polimorfija je pojavljivanje čvrste tvari u više inačica s različitim kristalnim strukturama. Različiti polimorfi imaju različite rasporede atoma unutar jedinične ćelije i imaju različita fizikalna svojstva. Prema broju polimorfa razlikujemo dimorfiju, trimorfiju itd. Kalcijev karbonat je dimorfan jer kristalizira heksagonski kao kalcit i rompski kao aragonit. Prevladavajuća kristalna struktura ovisi o temperaturi i tlaku.
Željezo je metal s polimorfnom strukturom. Svaka struktura je stabilna u određenom rasponu temperatura, na primjer, do temperature 912 °C željezo ima bcc kristalnu strukturu (α-željezo ili ferit). U temperaturnom području između 912 C i 1 394 °C kristalizira u fcc kristalnoj rešetki (γ-željezo ili austenit), a pri temperaturi 1 394 °C ponovo dolazi do polimorfne promjene iz fcc u bcc kristalnu strukturu (δ-željezo) koju zadržava do tališta.
Polimorfiju među elementima nazivamo alotropija.
polipeptid → polypeptide
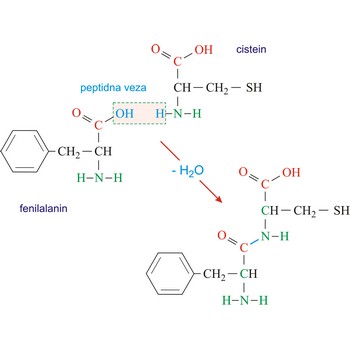
Polipeptidi su peptidi koji se sastoje od deset ili više aminokiselina. Svojstva polipeptida uvjetovana su tipom i rasporedom aminokiselina od kojih je sastavljen.
spektrofotometar → spectrophotometer
Spektrofotometar je instrument koji služi za mjerenje količine svjetla koju apsorbira uzorak.
Apsorpcija svjetlosti kroz otopine može se matematički opisati Beer-Lambertovim zakonom
gdje je A apsorbancija na danoj valnoj duljini svjetlosti, ε je molarni apsorpcijski (ekstinkcijski) koeficijent (L mol-1 cm-1), svojstven svakoj molekulskoj vrsti i ovisan o valnoj duljini svjetlosti, b je duljina puta svjetlosti kroz uzorak (cm) a c je koncentracija tvari u otopini (mol L-1).
superkritični fluid → supercritical fluid
Superkritični fluid je bilo koja tvar iznad svoje kritične temperature i kritičnog tlaka (vidi fazni dijagram). On ima jedinstvena svojstva koja se razlikuju i od plinova i od tekućina. Superkritični fluid ima svojstvo plina da penetrira u svaku poru kao i svojstvo tekućine da otapa materijale. Topljivost tvari raste s porastom gustoće (tj. s porastom tlaka). Primjerice, naftalen je praktički netopiv u niskotlačnom tekućem ugljičnom dioksidu. Na 100 bar topljivost je 10 g/L a na 200 bar je 50 g/L. Brzom ekspanzijom superkritične otopine dolazi do taloženja otopljene krutine.
superfluidni helij → superfluid helium
Superfluidnost helija otkrio je 1938. sovjetski fizičar Pyotr Leonidovich Kapitsa. Helij-4 pokazuje superfluidna svojstva kada se ohladi ispod 2.18 K (-270.97 °C), tzv. lamda-točka (λ). Pri ovim temperaturama tekući helij (helij II) je fluid s ekstremno niskom viskoznošću i ekstremno visokom specifičnom provodnošću topline. Toplinska vodljivost helija II je oko tri milijuna puta veća od helija I (tekući helij iznad 2.18 K). Ako se helij II stavi u neku posudu, tekućina će se penjati po unutrašnjoj strani a spuštati po vanjskoj strani posude.
termometar → thermometer
Termometri su sprave za mjerenje temperature. Linearno i volumensko toplinsko rastezanje makroskopska su svojstva tvari i lakše su mjerljiva od mikroskopskih svojstava, kojima se definira temperatura. Stoga se mjerenjem tih svojstava može odrediti temperatura. Termometri koji se zasnivaju na toplinskom rastezanju tvari su sekundarni instrumenti: moraju se baždariti, tako da se usporede s nekim standardnim termometrom. U termometru s tekućinom, živa ili alkohol se nalaze u staklenoj posudici. Povećanjem temperature povećava se volumen tekućine, što uzrokuje podizanje tekućine uskom kapilarnom cjevčicom. Visina razine tekućine u cjevčici je mjera temperature. Živinim termometrom mjere se temperature između -39 °C i 300 °C. Niže temperature mjere se alkoholnim termometrom. Bimetalni termometri imaju spiralnu oprugu sastavljenu od dva metala, različitih koeficijenata linearnog rastezanja. Promjenom temperature metali se različito produžuju pa se savijanje spirale prenosi na kazaljku, čiji otklon je mjera temperature.
tirozin → tyrosine
Tirozin je hidrofobna aminokiselina s aromatskim pobočnim lancem. Njegov veliki pobočni lanac obično ga smješta duboko u unutrašnjost bjelančevine. Tirozin ima specijalna svojstva zbog hidroksilne skupine na kraju svog pobočnog lanca koja može djelovati kao snažni nukleofilni centar (kad je ionizirana) u aktivnom mjestu enzima. On je često mjesto za fosforilaciju kod stanične signalizacije. Tirozin doprinosi apsorpciji UV zračenja bjelančevina (bjelančevine apsorbiraju UV zračenje između 275 i 280 nm). Ovo nije esencijalna aminokiselina jer se može sintetizirati u organizmu iz drugih metabolita.
- Kratice: Tyr, Y
- IUPAC ime: 2-amino-3-(4-hidroksifenil)propanska kiselina
- Molekularna formula: C9H11NO3
- Molekularna masa: 181.19 g/mol
T-S dijagram → T-S diagram
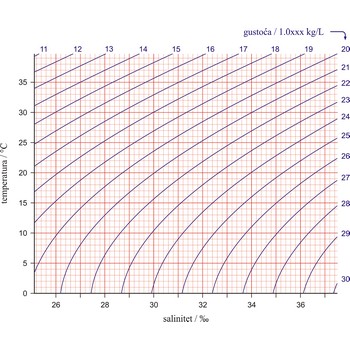
Prikazivanje podataka o temperaturi (T) i slanosti (S) mora pomoću T-S dijagrama jednostavan je ali moćan alat koji se koristi kod istraživanja gustoće, miješanja i cirkulacije mora i oceana. Na ordinatu je nanesena temperatura u Celzijevim stupnjevima a na apscisu salinite u jedinicama praktičnog saliniteta (PSU). Ucrtane linije predstavljaju plohe iste gustoće (izopikne). Gustoća je jedan od najvažnijih parametara koji određuju dinamička svojstva mora i oceana i glavni je pokretač stalnih strujanja mora i oceana (u horizontalnom i vertikalnom smjeru).
Citiranje ove stranice:
Generalić, Eni. "Koligativno svojstvo." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav