kvalitativna analiza → qualitative analysis
Kvalitativna analiza obuhvaća metode razdvajanja i dokazivanja kojima utvrđujemo od kojih je kemijskih elemenata ili spojeva sastavljena neka tvar. Kvalitativna anorganska analiza koristi se za određivanje kationa i aniona u otopini uzorka. Kationi su podijeljeni u šest skupina ovisno o topljivosti njihovih taloga sa skupnim reagensom.
radioaktivni indikator → radioactive indicator
Upotrebom odgovarajućih radioaktivnih izotopa mogu se pratiti biokemijski procesi u biljkama, životinjama i ljudima mjereći radioaktivno zračenje primiješanog radioaktivnog indikatora. Umjetni radioaktivni izotopi imaju iste kemijske osobine kao i prirodni izotopi što omogućuje da te prirodne izotope obilježimo primjesom radioaktivnih izotopa i tako slijedimo put tih elemenata tijekom kemijske reakcije. Jedan od najvažnijih radioaktivnih indikatora jest radioaktivni ugljik 14C.
radon → radon
Radon je 1900. godine otkrio Friedrich Ernst Dorn (Njemačka). Nastaje raspadom radija pa je po njemu i dobio ime. Prvotno je nazvan niton po latinskoj riječi nitens što znači sjajan. To je plin bez boje i mirisa. Radon je kemijski inertan, jednoatomni nezapaljivi plin. Ne spaja s drugim elementima izuzev s fluorom. Radon je radioaktivan, jako radiotoksičan i kancerogen ako se udiše. Radon nastaje kao produkt radioaktivnog raspada radija, a i sam se dalje radioaktivno raspada (3.8 dana).
relativna molekularna masa → relative molecular mass
Relativna molekularna masa (Mr) neke tvari jest omjer prosječne mase formulske jedinke i 1/12 mase atoma nuklida 12C, odnosno relativna molekularna masa jednaka je zbroju relativnih atomskih masa koje čine formulsku jedinku. Tako bi relativna molekularna masa sulfatne kiseline, Mr(H2SO4) bila:
Mr(H2SO4) = 2·Ar(H) + Ar(S) + 4·Ar(O)
= 2·1.0079 + 32.066 + 4·15.999
= 2.0158 + 32.066 + 63.996
= 98.078
reverzibilna reakcija → reversible reaction
Reverzibilna reakcija je kemijska reakcija koja može teći u oba smjera. Kada se brzine napredne i povratne reakcije izjednače uspostavlja se ravnoteža a koncentracija produkata i reaktanata više se ne mijenjaju. Reverzibilne reakcije označavaju se dvostrukom strelicom u oba smjera.
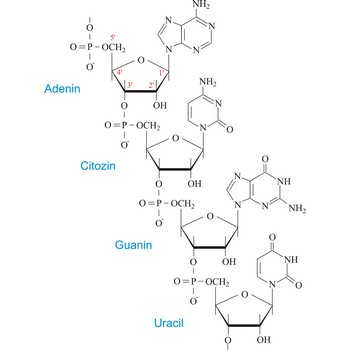
ribonukleinska kiselina → ribonucleic acid
Ribonukleinska kiselina (RNK ili RNA) je dugačka lančasta molekula koja služi kao posrednik između DNK i njihovog konačnog produkta, bjelančevina. Neki virusi koriste RNK molekule za prijenos genetskih informacija umjesto DNK.
Ribonukleinska kiselina i dezoksiribonukleinska kiselina kemijski su vrlo slične molekule. U RNK je pirimidinska baza timin zamijenjena uracilom, a šećer je riboza umjesto dezoksiriboze. RNK su sastavljene od dušičnih purinskih baza adenina i gvanina, dušičnih pirimidinskih baza citozina i uracila, šećera riboze i fosforne kiseline. Za razliku od DNK RNK je jednolančana molekula.
Imamo tri glavna tipa obzirom na funkciju RNK u stanici: (1) ribosomske RNK koje izgrađuju ribosome u citoplazmi; (2) glasničke (messengers), dugačke, nitaste, mjestimično poput čvorova savijene molekule velike molekularne mase, sastavljene od dugih nizova ribonukleotida; služe kao prijenos biološke uloge DNK iz jezgre u citoplazmu; (3) transportne (transfer) RNK relativno malih molekula sastavljenih od svega 75-90 nukleotida, molekularne mase oko 30 000.; prenose aminokiseline na ribosome, gdje se obavlja sinteza bjelančevina, koji su strukturne bjelančevine, enzimi ili hormoni odgovorni za osnovnu strukturu i funkciju živih organizama.
salinitet → salinity
Salinitet (S) je mjera za količinu otopljenih soli u morskoj vodi. Salinitet je definiran kao ukupna količina otopljenih soli u morskoj vodi u promilima, ‰, (djelovima na tisuću) kada se svi karbonati pretvore u okside, bromidi i jodidi u kloride i kada se sve organske tvari kompletno oksidiraju.
Klorinitet je najstarija metoda za mjerenje saliniteta koja, temeljem ideje o stalnom omjeru otopljenih komponenti morske vode, pruža uvid u ukupnu količinu otopljenih soli u morskoj vodi mjerenjem koncentracije halida (klorida, bromida i jodida). Odnos između kloriniteta (Cl) i saliniteta dan u Knudsenovim tablicama jest
Ova formula koristila se do 1962., kada je JPOTS (Joint Panel for Oceanographic Tables and Standards) odredilo novu konstantu proporcionalnosti u Knudsenovoj formuli
U međuvremenu, razvoj uređaja za mjerenje električne vodljivosti doveo je do brze, jeftine i precizne metode za određivanja slanosti morske vode. Uveden je Praktični salinitet (SP) kao zamjena za salinitet dobiven mjerenjem kloriniteta. Skala praktičnog saliniteta (Practical Salinity Scale 1978, PSS-78) definirana je preko K15, odnosno odnosa električne vodljivosti uzorka mora pri t68 = 15 °C i tlaku od jedne standardne atmosfere i otopine kalijevog klorida (KCl) u kojoj je maseni udio KCl točno 0.0324356 (32.4356 g KCl otopljeno je u 1 kg otopine) pri istom tlaku i temperaturi.
Praktični salinitet je bezdimenzijska veličina iako mu ponekad (pogrešno) pripisuju jedinicu "psu". U većini slučajeva može se pretpostaviti da su psu i ‰ sinonimi.
Prosječni salinitet morske vode je 35 ‰, što je oko 35 g soli otopljeno u 1 kg morske vode.
slana voda → salt water
Slana voda je voda iz mora i oceana. Sadrži relativno visoki postotak otopljenih soli (oko 35 g soli u 1 000 g morske vode). Oko 90 % otopljenih soli je obična kuhinjska sol (NaCl).
Salinitet morske vode varira: ovisi o topljenju leda, dotoku riječne vode, kiši, isparavanju i sl.
more → seawater
More, odnosno morska voda, nezasićena je homogena otopina koja se sastoji od vode kao otapala (96.5 %) i otopljenih soli (3.5 %) te manjih količina partikularne tvari, otopljenih plinova i organskih sastojaka. Veći dio Zemlje pokriven je morskom vodom. Od ukupne površine Zemlje (510 100 000 km2) svjetski oceani prekrivaju skoro 71 % (361 840 000 km2) s prosječnom dubinom od 3 682.2 m.
Gustoća morske vode je, zbog njene slanosti, viša od one čiste vode. Uz to, povećanjem slanosti vode snižava se temperatura ledišta a povisuje temperatura vrelišta mora. Prosječna slanost oceana je 35 ‰, što iznosi oko 35 g čvrste tvari otopljene u 1 kg morske vode. Ispitivanjem koncentracija najzastupljenijih soli u moru utvrđeno je da je njihov relativan odnos u moru konstantan bez obzira na njihovu apsolutnu količinu. Samo šest elemenata i spojeva čine oko 99 % otopljenih soli u moru: klorid (Cl-), natrij (Na+), sulfat (SO42-), magnezij (Mg2+), kalcij (Ca2+) i kalij (K+).
sedimentne stijene → sedimentary rocks
Sedimentne stijene nastaju akumulacijom i naknadnom konsolidacijome sedimenata u različite vrste stijena. Tri su glavna tipa sedimentnih stijena:
Klastične sedimentne stijene građene su od diskretnih fragmenata ili klasta nastalih iz drugih stijena.
Kemijske (kemogene) sedimentne stijene nastale precipitacijom, tj. izlučivanjem minerala iz zasićenih vodenih otopina.
Biogene (organogene) sedimentne stijene nastale akumuliranjem organske tvari (treset, ugljen, nafta) ili taloženjem anorganskih skeletnih dijelova, uglavnom morskih, organizama.
Ovisno o veličini sedimentne čestice podijeljene su u šest kategorija:
- blokovi (>256 mm)
- obluci (64 - 256 mm)
- šljunak (2 - 64 mm)
- pijesak (1/16 - 2 mm)
- mulj (1/256 - 1/16 mm)
- glina (<1/256 mm)
Citiranje ove stranice:
Generalić, Eni. "Kemijska formula." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav