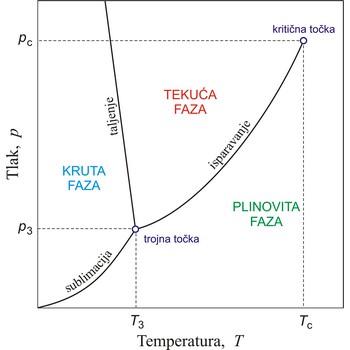
fazni dijagram → phase diagram
Ravnotežna stanja koja se uspostavljaju, pri određenim uvjetima, između pojedinih agregatnih stanja ili faza prikazuju se faznim dijagramom ili dijagramom stanja.
Krivulje na faznom dijagramu prikazuju ravnotežna stanja između dviju faza. Točku u kojoj su sve tri faze u ravnoteži nazivamo trojna točka. Krivulja isparavanja završava u kritičnoj točki. Iznad te temperature (kritična temperatura) ni u kojim uvjetima ne može se vodena para prevesti u tekuće stanje.
Tafelov dijagram → Tafel plot
Polarizirirana elektroda često daje odnos struje i potencijala po površini i može se aproksimirati sljedećim izrazom:
gdje je η promjena potencijala u strujnom krugu; i gustoća struje; B i i0 su konstante. B je konstanta poznata kao Tafelov nagib. Ako se ponašanje tog strujnog kruga promatra preko grafa, onda se graf ovih polulogaritamskih vrijednosti zove Tafelova linija, a dijagram se onda zove Tafelov dijagram.
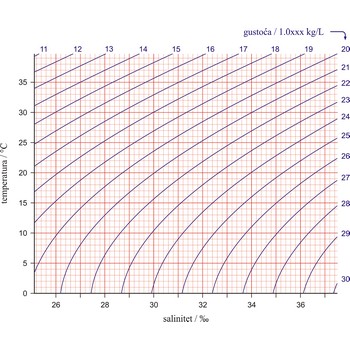
T-S dijagram → T-S diagram
Prikazivanje podataka o temperaturi (T) i slanosti (S) mora pomoću T-S dijagrama jednostavan je ali moćan alat koji se koristi kod istraživanja gustoće, miješanja i cirkulacije mora i oceana. Na ordinatu je nanesena temperatura u Celzijevim stupnjevima a na apscisu salinite u jedinicama praktičnog saliniteta (PSU). Ucrtane linije predstavljaju plohe iste gustoće (izopikne). Gustoća je jedan od najvažnijih parametara koji određuju dinamička svojstva mora i oceana i glavni je pokretač stalnih strujanja mora i oceana (u horizontalnom i vertikalnom smjeru).
kritična točka → critical point
Kritična točka je točka na faznom dijagramu dvofaznog sustava u kojoj dvije faze imaju jednaka svojstva i zbog toga čine jednu fazu. U kritičnoj točki za tekuću i plinovitu fazu čiste tvari nestaje razlika između tekućine i plina i u njoj završava krivulja napona pare. Koordinate ove točke jesu kritična temperatura i kritični tlak. Iznad kritične temperature fluid se ne može ukapljiti.
kritična temperatura → critical temperature
Kritična temperatura je maksimalna temperatura pri kojoj se plin može prevesti u tekuće stanje. Iznad kritične temperature tvar je u plinovitom agregatnom stanju neovisno o vanjskom tlaku.
superkritični fluid → supercritical fluid
Superkritični fluid je bilo koja tvar iznad svoje kritične temperature i kritičnog tlaka (vidi fazni dijagram). On ima jedinstvena svojstva koja se razlikuju i od plinova i od tekućina. Superkritični fluid ima svojstvo plina da penetrira u svaku poru kao i svojstvo tekućine da otapa materijale. Topljivost tvari raste s porastom gustoće (tj. s porastom tlaka). Primjerice, naftalen je praktički netopiv u niskotlačnom tekućem ugljičnom dioksidu. Na 100 bar topljivost je 10 g/L a na 200 bar je 50 g/L. Brzom ekspanzijom superkritične otopine dolazi do taloženja otopljene krutine.
trojna točka → triple point
Trojna točka je točka u p,T prostor gdje su čvrsta, tekuća i plinska faza tvari u termodinamičkoj ravnoteži.
Arheniusova jednadžba → Arrhenius equation
Jednadžba oblika
gdje je k konstanta brzine kemijske reakcije, A kolizijski faktor, Ea energija aktivacije, T temperatura, R plinska konstanta.
Dijagram ln k - 1/T jest pravac čiji je nagib -Ea/R a presjek s osi x lnA. Jednadžba se zove prema njenom autoru Svantu Arrheniusu.
azeotropi → azeotrope
Azeotropi su smjese dviju kapljevina koje vriju s konstantnim sastavom, tj. sastav pare isti je kao i sastav tekućine. Azeotropne smjese pokazuju maksimum ili minimum u dijagramu vrelište - sastav. Frakcijskom destilacijom azeotropne smjese mogu se dobiti jedna čista komponenta i azeotrop (smjesu konstantnog vrelišta). Sastav azeotropne smjese ovisi o tlaku.
Citiranje ove stranice:
Generalić, Eni. "Fazni dijagram." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav