samarij → samarium
Samarij je 1879. godine otkrio Paul Emile Lecoq de Boisbaudran (Francuska). Ime je dobio po mineralu samariskitu nazvanom tako u čast ruskog rudarskog inženjera Samarskog. To je srebrno bijeli metal koji je stabilan na suhom zraku. Oksidni sloj se formira na površini ako je izložen vlažnom zraku. Metal se sam zapali na zraku ako se zagrije na 150 °C. Glavni izvor teških lantanoida je gadolinit (Y, Ce, Cr, Be, Fe silikat), euksenit (sadrži Y, Ce, Er, Nb, Ti, U) i ksenotim (YPO4 s nešto Th i lakih lantanoida). Nalaze se i u monacitnim pijescima. Koristi se za izradu stakla koje apsorbira infracrveno zračenje, za izradu lasera i studijskih reflektora i kao apsorber neutrona u nuklearnom reaktoru. Upotrebljava se za izradu permanentnih magneta s najvećim otporom prema demagnetizaciji od svih poznatih materijala.
sekunda → second
Sekunda (s) je SI jedinica za vrijeme.
To je trajanje 9 192 631 770 perioda zračenja koje odgovara prijelazu između dvaju hiperfinih nivoa (od F = 4, mF = 0 do F = 3, mF = 0) osnovnog stanja atoma cezija 133 (133Cs). Periodu definiramo kao vrijeme potrebno da svjetlost prevali put koji odgovara jednoj valnoj duljini.
sediment → sediment
1. Sediment je usitnjeni materijal nastao djelovanjem vremenskih prilika na stijene. Zrnaca krutog materijala su transportirana vodom, vjetrom, ledom ili nekim drugim prirodnim procesima i taložena u slojevima. Pod utjecajem gravitacije i tektonskih kretanja sedimenti stvaraju sedimentne stijene.
2. Strogo gledajući, sediment je kruti materijal nastao taloženjem suspendirane tvari u tekućini.
sunčeva ćelija → solar cell
Sunčeva ili fotonaponska ćelija jest naprava koja sunčevu svjetlost pretvara u elektricitet. Sve sunčeve ćelije koriste se fotonaponskom pojavom, pa se često zovu fotonaponskim napravama. U većini ovih ćelija osnovni materijal čine poluvodiči, a najčešći je silicij.
Fotonaponska pojava zasniva se na stvaranju pokretnih nositelja naboja - elektrona i šupljina - uslijed apsorpcije fotona svjetlosti. Ovaj par naboja stvara se kad elektron u najvišoj popunjenoj elektronskoj vrpci poluvodiča (valentnoj vrpci) apsorbira foton dostatne energije i prijeđe u praznu elektronsku vrpcu (vodljivu vrpcu). Ovo pobuđenje može se inducirati samo fotonom čija energija odgovara širini energijskog procjepa koji razdvaja valentnu i vodljivu vrpcu. Stvaranje para naboja elektron-šupljina može se pretvoriti u električnu struju u poluvodičkoj napravi, u kojoj je sloj jednog poluvodiča spojen sa slojem drugačijeg poluvodiča ili pak metala. U većini poluvodičkih ćelija ovaj je spoj takozvani p-n spoj, tj. sučeljavaju se p-dopirani i n-dopirani poluvodič. Na sučelju višak pozitivnog naboja (šupljina) u p-dopiranom poluvodičkom sloju i višak negativnog naboja (elektrona) u n-dopiranom poluvodičkom sloju stvara električno polje, koje se prostire s obje strane sučelja. Kad se apsorpcijom fotona u ovom području stvori par elektron-šupljina, ovi naboji se, zbog djelovanja polja, udaljuju od sučelja krećući se u suprotnim smjerovima prema vrhu i dnu ćelije, gdje se nalaze metalne elektrode za skupljanje struje. Elektroda na vrhu (kroz koju se apsorbira svjetlost ) podijeljena je na trake tako da ne zaklanja poluvodički sloj. U većini komercijalnih ćelija p-n spoj se formira unutar monolitnog komada kristalnog silicija. Silicij apsorbira sunčevu svjetlost onih valnih duljina pri kojima je najintenzivnija, od bliskog infracrvenog područja (valnih duljina oko 1200 nm) do ljubičastog (valnih duljina oko 350 nm).
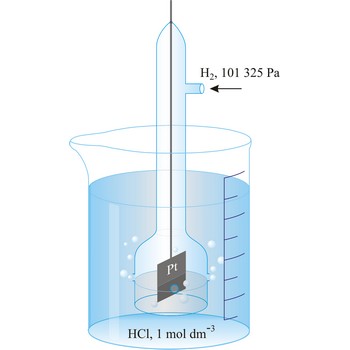
standardna vodikova elektroda → standard hydrogen electrode
Standardna vodikova elektroda sastoji se od elektrode od spužvaste platine uronjene u otopinu vodikovih iona aktiviteta 1 kroz koju se propušta plinoviti vodik pod tlakom od 101 325 Pa. Standardna vodikova elektroda u članku dogovorno se prikazuje uvijek lijevo
Redoks-potencijal standardne vodikove elektrode, pri svim temperaturama, dogovorno je uzet kao 0.
superkritični ugljikov dioksid → supercritical carbon dioxide
Superkritični ugljikov dioksid (scCO2) moćno je, jeftino, netoksično i ekološki prihvatljivo otapalo. Kada se upotrebljava u superkritičnom stanju (iznad 74 bar i 31 °C) ima sličan otapajući potencijal kao i njegovi organski suparnici, ugljikovodici i klorirana otapala. Superkritični ugljikov dioksid je jedno od rijetkih otapala koje se može bez ograničenja upotrebljavati u prehrambenoj industriji.
superfluidni helij → superfluid helium
Superfluidnost helija otkrio je 1938. sovjetski fizičar Pyotr Leonidovich Kapitsa. Helij-4 pokazuje superfluidna svojstva kada se ohladi ispod 2.18 K (-270.97 °C), tzv. lamda-točka (λ). Pri ovim temperaturama tekući helij (helij II) je fluid s ekstremno niskom viskoznošću i ekstremno visokom specifičnom provodnošću topline. Toplinska vodljivost helija II je oko tri milijuna puta veća od helija I (tekući helij iznad 2.18 K). Ako se helij II stavi u neku posudu, tekućina će se penjati po unutrašnjoj strani a spuštati po vanjskoj strani posude.
superoksid → superoxide
Superoksidi binarni su spojevi koji sadrže kisik sa stupnjem oksidacije -½. Superoksidni ion, O2-, ima nespareni elektronski par i vremenom se spontano disproporcionira u peroksid. Teži alkalijski elementi (K, Rb, Cs) stvaraju superokside direktnim spaljivanjem na zraku (KO2, RbO2, CsO2). To su žuto do narančasto obojeni paramagnetični spojevi. Superoksidi su jaki oksidansi koji burno hidroliziraju dajući peroksid i elementarni kisik.
terbij → terbium
Terbij je 1843. godine otkrio Carl Gustaf Mosander (Švedska). Ime je dobio po švedskom selu Ytterby gdje je nalazište gadolinita iz kojeg je prvi put izdvojen. To je srebrno sivi, kovki metal koji je toliko mekan da se može rezati nožem. Sporo se oksidira na zraku ali se zapali na zraku ako se zagrije. Reagira s hladnom vodom. Glavni izvor teških lantanoida je gadolinit (Y, Ce, Cr, Be, Fe silikat), euksenit (sadrži Y, Ce, Er, Nb, Ti, U) i ksenotim (YPO4 s nešto Th i lakih lantanoida). Nalaze se i u monacitnim pijescima. Koristi se za izradu fluorescentnih cijevi i zelenog fosfora u katodnim cijevima TV-prijemnika u boji.
prijelazni element → transition metal
Prijelazni elementi smješteni su središnjem dijelu periodnog sustava, u skupinama od 3. do 11. Popunjavaju d-podljuske prethodne ljuske, te ih zbog toga nazivamo i d-elementima.
Prvom nizu prijelaznih elemenata pripadaju skupine skandija (Sc), titanija (Ti), vanadija (V), kroma (Cr), mangana (Mn), željeza (Fe), kobalta (Co), nikla (Ni) i bakara (Cu). Često se i elementi 12. skupine (skupine cinka) svrstavaju u prijelazne elemente iako su d-podljuske već popunjene kod skupine bakra.
Unutar 6. i 7. periode nalaze se, u 3. podljusci, unutrašnji prijelazni elementi, (lantanoidi) i (aktinoidi). Prijelazni elementi su metali velike gustoće, tvrdoće i visokog tališta. Spojevi su im obično obojeni, a za njih je karakteristično stvaranje kompleksnih spojeva.
Citiranje ove stranice:
Generalić, Eni. "50 states program guide." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav