značajne znamenke → significant figures
Mjerenja nikad nisu beskrajno točna i mora se procijeniti mjera njihove neizvjesnosti. U nekom podatku mjerenja sve sigurne i prva nesigurna znamenka značajne su.
Pravila za određivanje značajnih znamenki jesu:
- Sve nule na početku broja zanemaruju se
- Sve nule na kraju broja zanemaruju se osim ako nisu iza decimalnog zareza
- Sve ostale znamenke, uključujući nulu između brojaka koje nisu nule, značajne su
Tako npr. broj
| 0.0023 | ima dvije značajne znamenke |
| 0.109 | ima tri značajne znamenke |
| 2.00 | ima tri značajne znamenke |
| 70 | ima jednu značajnu znamenku |
Rezultat treba imati samo značajne znamenke.
Prilikom zbrajanja i oduzimanja rezultat može imati onoliko znamenki iza decimalnog zareza koliko ih ima podatak s najmanjim brojem decimala (s najvećom apsolutnom pogreškom).
U množenju i dijeljenju rezultat treba imati onoliko značajnih znamenki koliko ih ima podatak s najmanjim brojem značajnih znamenki (s najvećom relativnom pogreškom). Ovo pravilo valja primijeniti s oprezom.
U logaritmu broja zadrži se onoliko znamenki desno od decimalnog zareza koliko je značajnih znamenki u izvornom broju
U antilogaritmu broja zadrži se onoliko znamenki koliko je znamenki desno od decimalnog zareza u izvornom broju.
spontani proces → spontaneous process
Spontani procesi oni su procesi koji se odvijaju bez vanjskog utjecaja. Vanjske sile nisu potrebne za održavanje procesa iako su ponekad potrebne da bi sam proces započeo. Npr. gorenje drva postaje spontani proces onog trena kad se zapali vatra. Spajanje vode i ugljikova dioksida u drvo i kisik nije spontani proces.
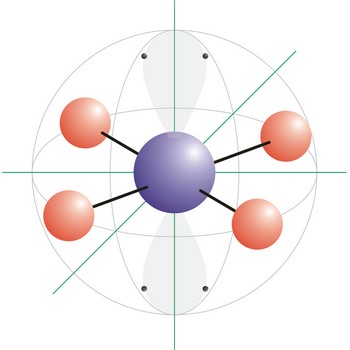
kvadratna planarna geometrija molekule → square planar molecular geometry
Kvadratna planarna geometrija molekule onaj je oblik molekule kod kojeg su četiri veze i dva slobodna elektronska para vezani na centralni atom molekule. Ksenonov tetraflurid (XeF4) primjer je kvadratne građe molekule. Nepodijeljeni elektronski parovi smještaju se u dva nasuprotna vrha oktaedra a fluorovi atomi u preostala četiri tvoreći kvadrat oko ksenona. Oktaedarski raspored elektronskih orbitala posljedica je sp3d2 (ili d2sp3) hibridizacije na centralnom atomu.
sunčeva ćelija → solar cell
Sunčeva ili fotonaponska ćelija jest naprava koja sunčevu svjetlost pretvara u elektricitet. Sve sunčeve ćelije koriste se fotonaponskom pojavom, pa se često zovu fotonaponskim napravama. U većini ovih ćelija osnovni materijal čine poluvodiči, a najčešći je silicij.
Fotonaponska pojava zasniva se na stvaranju pokretnih nositelja naboja - elektrona i šupljina - uslijed apsorpcije fotona svjetlosti. Ovaj par naboja stvara se kad elektron u najvišoj popunjenoj elektronskoj vrpci poluvodiča (valentnoj vrpci) apsorbira foton dostatne energije i prijeđe u praznu elektronsku vrpcu (vodljivu vrpcu). Ovo pobuđenje može se inducirati samo fotonom čija energija odgovara širini energijskog procjepa koji razdvaja valentnu i vodljivu vrpcu. Stvaranje para naboja elektron-šupljina može se pretvoriti u električnu struju u poluvodičkoj napravi, u kojoj je sloj jednog poluvodiča spojen sa slojem drugačijeg poluvodiča ili pak metala. U većini poluvodičkih ćelija ovaj je spoj takozvani p-n spoj, tj. sučeljavaju se p-dopirani i n-dopirani poluvodič. Na sučelju višak pozitivnog naboja (šupljina) u p-dopiranom poluvodičkom sloju i višak negativnog naboja (elektrona) u n-dopiranom poluvodičkom sloju stvara električno polje, koje se prostire s obje strane sučelja. Kad se apsorpcijom fotona u ovom području stvori par elektron-šupljina, ovi naboji se, zbog djelovanja polja, udaljuju od sučelja krećući se u suprotnim smjerovima prema vrhu i dnu ćelije, gdje se nalaze metalne elektrode za skupljanje struje. Elektroda na vrhu (kroz koju se apsorbira svjetlost ) podijeljena je na trake tako da ne zaklanja poluvodički sloj. U većini komercijalnih ćelija p-n spoj se formira unutar monolitnog komada kristalnog silicija. Silicij apsorbira sunčevu svjetlost onih valnih duljina pri kojima je najintenzivnija, od bliskog infracrvenog područja (valnih duljina oko 1200 nm) do ljubičastog (valnih duljina oko 350 nm).
kvadratna piramidalna geometrija molekule → square pyramidal molecular geometry
Kvadratna piramidalna geometrija molekule onaj je oblik molekule kod kojeg su pet veza i jedan slobodan elektronski par vezani na centralni atom molekule. Bromov pentafluorid (BrF5) primjer je molekule koja ima geometriju kvadratne piramide. Smještaj nepodijeljenog elektronskog para potpuno je proizvoljan jer su svih šest elektronskih skupina ekvivalentne. Oktaedarski raspored elektronskih orbitala posljedica je sp3d2 (ili d2sp3) hibridizacije na centralnom atomu.
Tafelov dijagram → Tafel plot
Polarizirirana elektroda često daje odnos struje i potencijala po površini i može se aproksimirati sljedećim izrazom:
gdje je η promjena potencijala u strujnom krugu; i gustoća struje; B i i0 su konstante. B je konstanta poznata kao Tafelov nagib. Ako se ponašanje tog strujnog kruga promatra preko grafa, onda se graf ovih polulogaritamskih vrijednosti zove Tafelova linija, a dijagram se onda zove Tafelov dijagram.
tetraedarska geometrija molekule → tetrahedral molecular geometry
Tetraedarska geometrija molekule onaj je oblik kod kojeg u molekuli postoje četiri veze na centralnom atomu bez slobodnih elektronskih parova. Atomi vezani na centralni atom leže na vrhovima tetraedra s kutom od 109.5° između njih. Tetraedarski raspored elektronskih orbitala posljedica je sp3 hibridizacije na centralnom atomu. Npr. amonijev ion (NH4+) i metan (CH4) imaju tetraedarsku geometriju molekule.
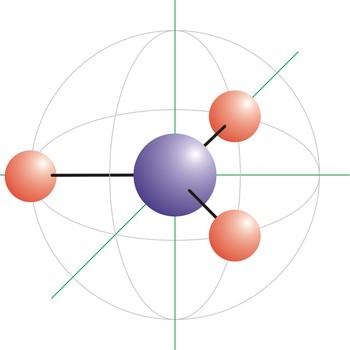
trigonska planarna geometrija molekule → trigonal planar molecular geometry
Trigonska planarna geometrija molekule onaj je oblik kod kojeg su tri veze vezane na centralni atom u molekuli bez ijednog slobodnog para elektrona. Veze su raspoređene u ekvatorijalnoj ravnini s međusobnim kutovima od 120°. Elektronske orbitale usmjerene prema vrhovima trokuta posljedica su sp2 hibridizacije na centralnom atomu. Karbonatni ion (CO32-) ima trigonsku planarnu geometriju molekule.
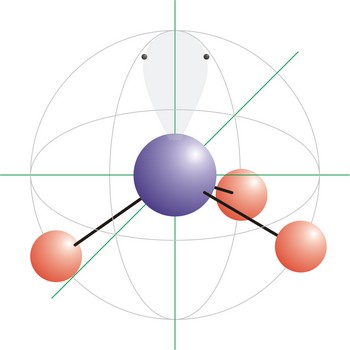
trigonska piramidalna geometrija molekule → trigonal pyramidal molecular geometry
Trigonska piramidalna geometrija molekule onaj je oblik molekule kod kojeg su tri veze i jedan slobodan elektronski par vezani na centralni atom molekule. Tetraedarski raspored elektronskih orbitala posljedica je sp3 hibridizacije na centralnom atomu. Molekula amonijaka (NH3) ima trigonsku piramidalnu geometriju.
volfram → tungsten
Volfram su 1783. godine otkrili braća Fausto i Juan Jose de Elhuyar (Španjolska). Ime je dobio po mineralu volframitu. Nastalo je od njemačkog prijevoda latinskog naziva volframove rude lupi spuma što znači vučja pjena. To je sjajni, vrlo tvrdi, srebrno bijeli metal. Dobiva se u obliku sivog praha. Čisti metal može se pilati, kovati i izvlačiti, ali ako je onečišćen onda je jako krt. Otporan je na djelovanje kisika iz zraka. Kiseline i lužine ga ne otapaju. Otapa se tek u rastaljenim lužinama. U Zemljinoj kori ima ga otprilike sto puta manja od kroma. Glavne rude volframa su volframit ((Fe, Mn)WO4), šelit (CaWO4), ferberit (FeWO4) i huebnerit (MnWO4). Oko 90 % proizvodnje volframa upotrebljava se u metalurgiji. Čelik legiran s volframom zadržava tvrdoću na visokim temperaturama pa se upotrebljava za izradu brzoreznih alata. Metalni prah izvlači se u fine žice od kojih se proizvode žarne niti u električnim žaruljama.
Citiranje ove stranice:
Generalić, Eni. "ハンドサイン one two three 英語." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav