precipitat → precipitate
Precipitat ili talog netopljiva je čvrsta tvar nastala reakcijom u otopini. Primjerice, kada se otopina srebrovog nitrata doda u otopinu natrijeva klorida istaloži se netopljivi srebrov klorid.
ionski izmjenjivač → ion exchanger
Ionski izmjenjivači su visokopolimerni spojevi koji imaju svojstvo da vežu ione iz otopine, a pri tome oslobađaju ekvivalentnu količinu istoimeno nabijenih iona. Ion izmjenjivačke smole sadrže različite kopolimere čvrsto vezane u trodimenzionalanu strukturu na koju su pričvršćene ionske skupine. Ovisno o strukturi imamo kationske i anionske izmjenjivače. Upotrebljavaju se za prečišćavanje različitih otopina, lijekova, demineraliziranje vode i dr.
more → seawater
More, odnosno morska voda, nezasićena je homogena otopina koja se sastoji od vode kao otapala (96.5 %) i otopljenih soli (3.5 %) te manjih količina partikularne tvari, otopljenih plinova i organskih sastojaka. Veći dio Zemlje pokriven je morskom vodom. Od ukupne površine Zemlje (510 100 000 km2) svjetski oceani prekrivaju skoro 71 % (361 840 000 km2) s prosječnom dubinom od 3 682.2 m.
Gustoća morske vode je, zbog njene slanosti, viša od one čiste vode. Uz to, povećanjem slanosti vode snižava se temperatura ledišta a povisuje temperatura vrelišta mora. Prosječna slanost oceana je 35 ‰, što iznosi oko 35 g čvrste tvari otopljene u 1 kg morske vode. Ispitivanjem koncentracija najzastupljenijih soli u moru utvrđeno je da je njihov relativan odnos u moru konstantan bez obzira na njihovu apsolutnu količinu. Samo šest elemenata i spojeva čine oko 99 % otopljenih soli u moru: klorid (Cl-), natrij (Na+), sulfat (SO42-), magnezij (Mg2+), kalcij (Ca2+) i kalij (K+).
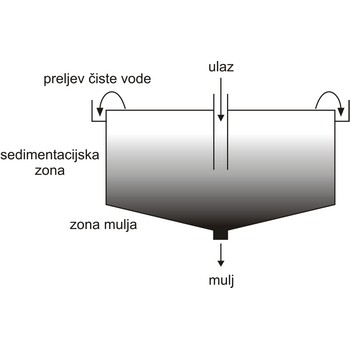
sedimentiranje → sedimentation
Sedimentiranje je postupak odjeljivanja specifično teže suspendirane tvari od otopine. Čvrsta tvar se slegne na dno a tekućina se iznad nje odlije (dekantira). Sedimentacijska zona zauzima najveći dio sedimentacijskog bazena. To je mirno područje u kojem se čestice talože. Na dnu bazena je kompresijska zona u kojoj se skuplja mulj prije uklanjanja na odlagalište ili daljnju obradu.
sol → sol
Solovi su disperzije čvrstih čestica u tekućini. Ove čestice mogu biti makromolekule ili nakupine malih molekula. Liofobni solovi su takvi solovi kod kojih ne postoji afinitet između dispergirane faze i tekućine (npr. srebrov klorid u vodi). Liofobni solovi su po prirodi nestabilni i s vremenom koaguliraju i istalože se. Liofilni solovi, u drugu ruku, mnogo su sličniji pravim otopinama. Stabilni su i teško se koaguliraju (npr. škrob u vodi).
topljivost → solubility
Topljivost je najveća količina neke tvari koja se može otopiti u nekoj količini otapala pri određenoj temperaturi. Općenito, topljivost čvrstih tvari u tekućinama raste s temperaturom a topljivost plinova opada. Topljivost se obično izražava masom otopljene tvari po masi otopine (maseni udio), molnim udjelom otopljene tvari, molalitetom, koncentracijom, i drugim.
dipolarni ion → zwitterion
Dipolarni ili dvojni ion (zwitterion), poznat i kao unutarnja sol, jest ion koji ima pozitivan i negativan naboj na različitim mjestima iste molekule. Kako ion na sebi istovremeno ima suprotne naboje električki je neutralan. Dipolarni ioni nastaju iz spojeva koji u svojim molekulama imaju i kisele i bazne skupine (amfoliti).
Sve aminokiseline koje se mogu naći u bjelančevinama (proteinima) su amfoliti je sadrže kiselu karboksilnu skupinu (-COOH) i baznu amino skupinu (-NH2). Aminokiseline u čvrstom stanju nalaze se u obliku dipolarnog iona. Dodatkom kiseline u otopinu koja sadrži dipolarne ione aminokiseline karboksilatna skupina prima proton (H+) i aminokiselina postaje pozitivno nabijena. Dodatkom lužine amino skupina gubi proton pri čemu aminokiselina postaje negativno nabijena.
apsorbancija → absorbance
Apsorbancija (A) je logaritam omjera intenziteta upadnog zračenja (Po) i propuštenog zračenja (P) kroz uzorak (izuzimajući efekte posude u kojoj je uzorak).
Apsorpcija svjetlosti kroz otopine može se matematički opisati Beer-Lambertovim zakonom
gdje je A apsorbancija na danoj valnoj duljini svjetlosti, ε je molarni apsorpcijski (ekstinkcijski) koeficijent (L mol-1 cm-1), svojstven svakoj molekulskoj vrsti i ovisan o valnoj duljini svjetlosti, b je duljina puta svjetlosti kroz uzorak (cm) a c je koncentracija tvari u otopini (mol L-1).
Citiranje ove stranice:
Generalić, Eni. "čvrste otopine." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav