barometar → barometer
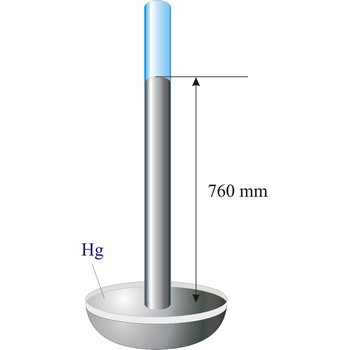
Barometar (grč. tlak + metar) je naprava za mjerenje atmosferskog tlaka. Za apsolutna mjerenja tlaka najpogodniji su barometri sa živom. Staklena cijev, zatvorena na jednom kraju, napuni se živom i pažljivo uroni otvorenim krajem u posudu sa živom. Živa u cijevi spusti se ostavljajući vakuum iznad nje a visina stupca žive varira ovisno o atmosferskom tlaku (1 atm = 760 mm Hg).
bazno centrirana monoklinska rešetka → base-centered monoclinic lattice
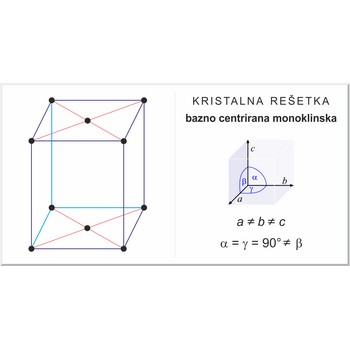
Bazno centrirana monoklinska rešetka (označava se sa C), kao i sve ostale rešetke ima po jedan čvor kristalne rešetke u svakom uglu jedinične ćelije plus po jedan dodatni čvor na sredini dvije paralelne stranice jedinične ćelije. Kristalografski vektori jedinične ćelije su a≠b≠c a kutovi među njima α=γ=90°≠β.
bazno centrirana ortorompska rešetka → base-centered orthorhombic lattice
Bazno centrirana ortorompska rešetka (označava se sa C), kao i sve ostale rešetke ima po jedan čvor kristalne rešetke u svakom uglu jedinične ćelije plus po jedan dodatni čvor na sredini dvije paralelne stranice jedinične ćelije. Kristalografski vektori jedinične ćelije su a≠b≠c a kutovi među njima α=β=γ=90°.
Beerov zakon → Beer’s law
Beerov zakon (naziva se i Beer-Lambertov zakon) daje funkcijski odnos između veličine mjerene apsorpcijskom metodom (A) i veličine koja se određuje, koncentracije (c). Posljedica međudjelovanja fotona i čestica koje apsorbiraju jest smanjenje snage snopa s Po na P. Beerov zakon može se prikazati kao
gdje je A apsorbancija na danoj valnoj duljini svjetlosti, ε je molarni apsorpcijski (ekstinkcijski) koeficijent (L mol-1 cm-1), svojstven svakoj molekulskoj vrsti i ovisan o valnoj duljini svjetlosti, b je duljina puta svjetlosti kroz uzorak (cm) a c je koncentracija tvari u otopini (mol L-1).
benzen → benzene
Benzen (benzol), C6H6, najjednostavniji je aromatski ugljikovodik, lako hlapiva tekućina karakteristična mirisa, vrelišta 80 °C, netopljiva u vodi, topljiva u benzinu, alkoholu i eteru. Gori jako čađavim plamenom, a pomiješan sa zrakom stvara eksplozivnu smjesu. Pare su mu vrlo otrovne.
Njemački kemičar Friedrich August Kekulé je, 1865., predložio strukturu molekule benzena kao heksagonalni prsten koji se sastoji od šest atoma ugljika s naizmjeničnim jednostrukim i dvostrukim ugljik-ugljik vezama. Takva struktura kaže da bi benzen trebao biti vrlo reaktivan ali to nije slučaj. Mi danas znamo da je struktura benzena doista šesterokutna, kod koje su sve C-C veze jednake i čija se duljina nalazi između onih za jednostruku i dvostruku vezu. To je objašnjeno time da se π-orbitale susjednih ugljikovih atoma preklapaju i tvore delokaliziranu molekulsku orbitalu koja se proteže oko prstena, dajući mu dodatnu stabilnost i sukladno tomu smanjenu reaktivnost. To je razlog zašto se strukturna formula benzena predstavlja kao šesterokut s krugom u sredini koji predstavlja delokalizirane elektrone.
izotermni proces → isothermal process
Izotermni proces je termodinamički proces u kojem se temperatura sustava ne mijenja.
Citiranje ove stranice:
Generalić, Eni. "Periodni_sustav_elemenata." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav