proton → proton
Protoni su sastavni dijelovi atomske jezgre i o njihovom broju ovisi naboj jezgre. Redni broj elementa jednak je broju protona. Masa protona (mp) iznosi 1.672×10-27 kg, a naboj je +1 e.
Godine 1886. njemački fizičar Eugene Goldstein (1850.-1930.) primijetio je da u modificiranoj Crookesovoj cijevi sa šupljom katodom nastaju zrake koje se šire od anode (pozitivnog pola) i prolaze kroz katodu. Te pozitivne čestice Rutherford je nazvao protonima.
radon → radon
Radon je 1900. godine otkrio Friedrich Ernst Dorn (Njemačka). Nastaje raspadom radija pa je po njemu i dobio ime. Prvotno je nazvan niton po latinskoj riječi nitens što znači sjajan. To je plin bez boje i mirisa. Radon je kemijski inertan, jednoatomni nezapaljivi plin. Ne spaja s drugim elementima izuzev s fluorom. Radon je radioaktivan, jako radiotoksičan i kancerogen ako se udiše. Radon nastaje kao produkt radioaktivnog raspada radija, a i sam se dalje radioaktivno raspada (3.8 dana).
referentna elektroda → referent electrode
Referentna elektroda je elektroda čiji je potencijal poznat i potpuno neovisan o koncentraciji analita. Kao referentne elektrode najčešće se koriste kalomel i srebro/srebrov klorid elektroda.
Tablica: Ovisnost potencijala referentnih elektroda o temperaturi i koncentraciji KCl
| Potencijal prema SHE / V | |||||
| kalomel elektroda | Ag/AgCl elektroda | ||||
| t / °C | 0.1 mol dm-3 | 3.5 mol dm-3 | zasić. otopina | 3.5 mol dm-3 | zasić. otopina |
| 15 | 0.3362 | 0.254 | 0.2511 | 0.212 | 0.209 |
| 20 | 0.3359 | 0.252 | 0.2479 | 0.208 | 0.204 |
| 25 | 0.3356 | 0.250 | 0.2444 | 0.205 | 0.199 |
| 30 | 0.3351 | 0.248 | 0.2411 | 0.201 | 0.194 |
| 35 | 0.3344 | 0.246 | 0.2376 | 0.197 | 0.189 |
moment tromosti → rotational inertia
Moment tromosti tijela definira se kao
za sustav materijalnih točaka pri čemu je masa pojedine materijalne točke mi, ili kao
za tijelo kontinuirano raspodijeljene mase, pri čemu je element mase dm. ri, odnosno r, predstavlja okomitu udaljenost od osi rotacije do pojedine mase odnosno elementa mase.
SI jedinica za moment tromosti je kg m2.
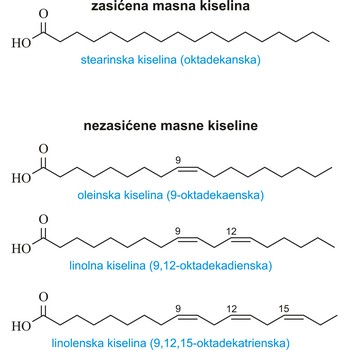
zasićena masna kiselina → saturated fatty acid
Zasićene masne kiseline su kiseline koje imaju maksimalni broj vodikovih atoma vezan za ugljikovodični lanac (nemaju dvostrukih veza između ugljikovih atoma). Najvažnije od njih su:
| maslačna (butanska kiselina) | CH3(CH2)2COOH |
| laurinska (dodekanska kiselina) | CH3(CH2)10COOH |
| miristinska (tetradekanska kiselina) | CH3(CH2)12COOH |
| palmitinska (heksadekanska kiselina) | CH3(CH2)14COOH |
| stearinska (oktadekanska kiselina) | CH3(CH2)16COOH |
| arahinska (eikosanoidna kiselina) | CH3(CH2)18COOH |
salinitet → salinity
Salinitet (S) je mjera za količinu otopljenih soli u morskoj vodi. Salinitet je definiran kao ukupna količina otopljenih soli u morskoj vodi u promilima, ‰, (djelovima na tisuću) kada se svi karbonati pretvore u okside, bromidi i jodidi u kloride i kada se sve organske tvari kompletno oksidiraju.
Klorinitet je najstarija metoda za mjerenje saliniteta koja, temeljem ideje o stalnom omjeru otopljenih komponenti morske vode, pruža uvid u ukupnu količinu otopljenih soli u morskoj vodi mjerenjem koncentracije halida (klorida, bromida i jodida). Odnos između kloriniteta (Cl) i saliniteta dan u Knudsenovim tablicama jest
Ova formula koristila se do 1962., kada je JPOTS (Joint Panel for Oceanographic Tables and Standards) odredilo novu konstantu proporcionalnosti u Knudsenovoj formuli
U međuvremenu, razvoj uređaja za mjerenje električne vodljivosti doveo je do brze, jeftine i precizne metode za određivanja slanosti morske vode. Uveden je Praktični salinitet (SP) kao zamjena za salinitet dobiven mjerenjem kloriniteta. Skala praktičnog saliniteta (Practical Salinity Scale 1978, PSS-78) definirana je preko K15, odnosno odnosa električne vodljivosti uzorka mora pri t68 = 15 °C i tlaku od jedne standardne atmosfere i otopine kalijevog klorida (KCl) u kojoj je maseni udio KCl točno 0.0324356 (32.4356 g KCl otopljeno je u 1 kg otopine) pri istom tlaku i temperaturi.
Praktični salinitet je bezdimenzijska veličina iako mu ponekad (pogrešno) pripisuju jedinicu "psu". U većini slučajeva može se pretpostaviti da su psu i ‰ sinonimi.
Prosječni salinitet morske vode je 35 ‰, što je oko 35 g soli otopljeno u 1 kg morske vode.
značajne znamenke → significant figures
Mjerenja nikad nisu beskrajno točna i mora se procijeniti mjera njihove neizvjesnosti. U nekom podatku mjerenja sve sigurne i prva nesigurna znamenka značajne su.
Pravila za određivanje značajnih znamenki jesu:
- Sve nule na početku broja zanemaruju se
- Sve nule na kraju broja zanemaruju se osim ako nisu iza decimalnog zareza
- Sve ostale znamenke, uključujući nulu između brojaka koje nisu nule, značajne su
Tako npr. broj
| 0.0023 | ima dvije značajne znamenke |
| 0.109 | ima tri značajne znamenke |
| 2.00 | ima tri značajne znamenke |
| 70 | ima jednu značajnu znamenku |
Rezultat treba imati samo značajne znamenke.
Prilikom zbrajanja i oduzimanja rezultat može imati onoliko znamenki iza decimalnog zareza koliko ih ima podatak s najmanjim brojem decimala (s najvećom apsolutnom pogreškom).
U množenju i dijeljenju rezultat treba imati onoliko značajnih znamenki koliko ih ima podatak s najmanjim brojem značajnih znamenki (s najvećom relativnom pogreškom). Ovo pravilo valja primijeniti s oprezom.
U logaritmu broja zadrži se onoliko znamenki desno od decimalnog zareza koliko je značajnih znamenki u izvornom broju
U antilogaritmu broja zadrži se onoliko znamenki koliko je znamenki desno od decimalnog zareza u izvornom broju.
srebro → silver
Srebro je poznato od davnih vremena (~3000. godine prije Krista). Ime je dobilo po latinskoj riječi argentum što znači bijel, sjajan. To je bijeli metal visokog sjaja, neobično kovak i rastezljiv. Najbolji je vodič topline i električne struje od svih metala. Na zraku ne oksidira, ali nakon nekog vremena potamni zbog reakcije s tragovima sumporvodika u zraku pri čemu nastaje crni sulfid. Topljiv je samo u oksidirajućim kiselinama, kao što su vruća koncentrirana sulfatna i nitratna kiselina. Srebrni ion ima baktericidno djelovanje pa voda u srebrnoj posudi dugo ostaje svježa. Srebro se u prirodi može naći elementarno ili u obliku argenita (Ag2S). Uglavnom se dobiva kao nusproizvod pri proizvodnji olova i bakra. Služi za posrebrivanje manje plemenitih metala, za izradu ogledala i fotografskih filmova. Od srebra se izrađuje nakit i legure sa zlatom i bakrom.
natrij → sodium
Natrij je 1807. godine otkrio Sir Humphry Davy (Engleska). Još u starom zavjetu spominje se neter kao sredstvo za pranje. Arapski alkemičari promijenili su latinski naziv nitrum u natron odakle i potječe današnji naziv natrija. To je mekani, srebrno bijeli metal čija se svježe odrezana površina trenutno oksidira. Reagira burno s vodom, pri čemu se nastali vodik zbog topline reakcije sam zapali. Spada među najjača redukcijska sredstva. U Zemljinoj kori ga je toliko mnogo da je teško naći uzorak bez spojeva natrija. Najviše ga ima u raznim aluminosilikatima, kamenoj soli (NaCl) i čilskoj salitri (NaNO3). Velike količine natrijeva klorida otopljene su u moru. Elementarni natrij koristi se u organskoj sintezi, za natrijeve lampe i fotoelektrične ćelije kao i za dobivanje spojeva koji se ne mogu drukčije pripraviti.
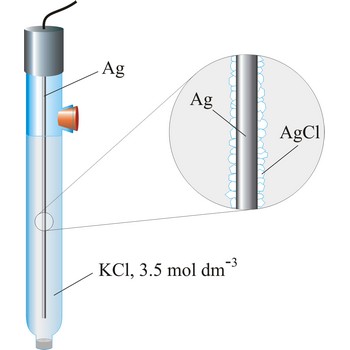
srebro/srebrov klorid elektroda → silver/silver-chloride electrode
Srebro/srebrov klorid elektroda je najčešće korištena referentna elektroda zbog svoje jednostavnosti, neotrovnosti, niske cijene i stabilnosti. Najčešći se puni zasićenim kalijevim kloridom ali može biti punjena i kalijevim kloridom nižih koncentracija, npr. 3.5 mol dm-3 ili 1 mol dm-3. Rad srebro/srebrov klorid elektrode temelji se na polureakciji
Tablica: Ovisnost potencijala srebro/srebrov klorid elektrode o temperaturi i koncentraciji KCl prema standardnoj vodikovoj elektrodi
| potencijal prema SHE / V | ||
|---|---|---|
| t / °C | 3.5 mol dm-3 | zasić. otop. |
| 15 | 0.212 | 0.209 |
| 20 | 0.208 | 0.204 |
| 25 | 0.205 | 0.199 |
| 30 | 0.201 | 0.194 |
| 35 | 0.197 | 0.189 |
Citiranje ove stranice:
Generalić, Eni. "Periodic table of the elements." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav