francij → francium
Francij je 1939. godine otkrila Marguerite Perey (Francuska). Ime mu je dala M. Perey u čast svoje domovine Francuske. Francij je radioaktivan element. Najstabilniji izotop (223Fr) ima vrijeme poluraspada od 22 minute. Francij nastaje kao produkt radioaktivnog raspada aktinija. U tragovima je pronađen u uranovim rudama.
Glauberova sol → Glauber’s salt
Glauberova sol je natrijev sulfat dekahidrat (Na2SO4×10H2O). Gubi kristalnu vodu pri 100 °C. Toplinski kapacitet joj je sedam puta veći od toplinskog kapaciteta vode.
radioaktivnost → radioactivity
Radioaktivnost je sposobnost spontanog raspadanja atoma pri čemu nastaje nova atomska vrsta i radioaktivno zračenje. Atom može emitirati tri vrste zračenja: pozitivno α-zračenje, negativno β-zračenje i električki neutralno γ-zračenje. Prilikom raspadanja jedan element nikad ne emitira istovremeno sve vrste zračenja.
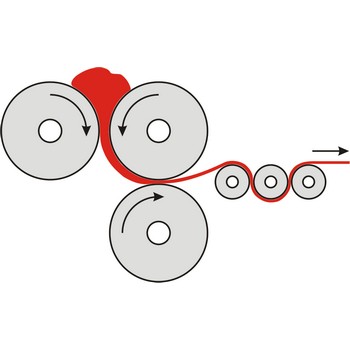
kalandriranje → calendering
Kalandriranje je proces oblikovanja materijala u tanke filmove (foliju) njegovim provlačenjem između zagrijanih valjaka.
elektroda trećeg reda → electrode of the third kind
Elektrode trećeg reda jesu metalne elektrode kojima je elektrodni potencijal funkcija koncentracije nekog drugog kationa, ali ne kationa metala od kojeg je elektroda. U ovom slučaju metal je u kontaktu s dvije teško topljive soli (jedna ima kation metala elektrode, a druga ima kation kojemu trebamo odrediti koncentraciju, a obje soli imaju isti anion) uronjene u otopinu soli drugog metala (npr. cink--cinkov oksalat--kalcijev oksalat-- otopina kalcijeve soli). Potencijal ove elektrode ovisi o koncentraciji njenog kationa u otopini, ali njegova je koncentracija kontrolirana koncentracijom aniona preko produkta topljivosti. Koncentracija zajedničkog aniona opet je u ovisnosti o koncentraciji kationa druge teško topljive soli. Ove su elektrode vrlo trome i nestabilne što je posljedica serije ravnoteža koje se moraju uspostavit prije nego što se dobije stabilni potencijal.
samozapaljivi materijal → spontaneously combustible
Samozapaljivi materijali oni su materijali koji se spontano mogu zapaliti bez vanjskog izvora topline. Toplina potrebna za zapaljenje može se generirati i običnom reakcijom s kisikom iz zraka, apsorpcijom vlage, toplinom generiranom tijekom obrade ili čak radioaktivnim raspadom.
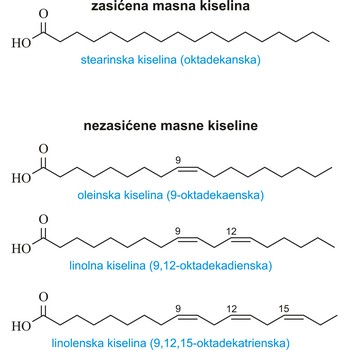
masna kiselina → fatty acid
Masne kiseline jesu alifatske monokarboksilne kiseline koje su karakterizirane terminalnom karboksilnom skupinom (R-COOH). Viši članovi ovog niza pojavljuju se u prirodi u obliku estera glicerola (masti) zbog čega se cijela obitelj ovih spojeva naziva masne kiseline. Prirodne masne kiseline obično su građene od 4 do 28 ugljikovih atoma u lancu (obično imaju paran broj) a mogu biti zasićene i nezasićene. Najvažnije zasićene masne kiseline jesu maslačna (C4), laurinska (C12), palmitinska (C16) i stearinska (C18). Od nezasićenih masnih kiselina najčešće se sreću oleinska, linolna i linolenska (sve imaju 18 ugljikovih atoma u lancu).
Fizikalna svojstva masnih kiselina ovise o dužini lanca, stupnju nezasićenosti i razgranatosti lanca. Kiseline s kratkim lancem jesu tekućine oštrog mirisa topljive u vodi. Porastom dužine lanca talište im raste a topljivost u vodi opada. Nezasićene masne kiseline i one s razgranatim lancem imaju niže talište.
grafit → graphite
Grafit je alotrop ugljika. Dobar je vodič topline i elektriciteta. U grafitu atomi su povezani u heksagonalne prstenove koji su složeni u slojevima. Kako ovi slojevi lako klize jedan preko drugog grafit se često koristi kao kruto mazivo. Sintetski grafit dobiva se zagrijavanjem smjese gline (aluminijeva silikata) i koksa u procesu koji je izumio američki kemičar Edward Goodrich Acheson (1856.–1931.). U reakciji nastaje silicijev karbid koji pri 4150 °C gubi silicij ostavljajući čisti grafit.
vrijeme poluraspada → half-life
Za jednostavno radioaktivno raspadanje vrijeme poluraspada, t1/2, definirano je kao vrijeme potrebno da se aktivnost nekog radioaktivnog izotopa smanji na polovicu svoje prvobitne vrijednosti.
Što je brzina raspada veća, to je vrijeme poluraspada manje. Poluživot je karakteristično svojstvo za svaki radioaktivni izotop i neovisno je o početnoj količini radioaktivnog izotopa i uvjetima.
halogenirani ugljikovodik → halocarbon
Halogenirani ugljikovodici su spojevi koji sadržavaju samo ugljik, jedan ili više halogena, i ponekad vodik, primjerice ugljikov tetraklorid ili tetraklorometan (CCl4), tetrabromometan (CBr4). Niži članovi različitih homolognih nizova koriste se kao sredstva za hlađenje, sredstva za gašenje požara i kao sredstva za pjenjenje poliuretanske pjene. Polimerizacijom halogeniranih ugljikovodika nastaju plastične mase koje karakterizira visoka kemijska otpornost, visoka električna otpornost i dobra toplinska stabilnost.
Citiranje ove stranice:
Generalić, Eni. "Decay series." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav