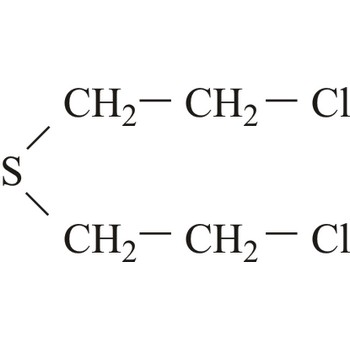Mohsova skala → Moh’s scale
Mohsova skala tvrdoće minerala je skala po kojoj se određuje i izražava tvrdoća pojedinih minerala. Napravio ju je njemački mineralolog Friedrich Mohs (1773.-1839.) i karakterizira je otpornost na grebanje tvrđim mineralom. Mohs je svoju ljestvicu temeljio na deset lako dostupnih minerala.
| Tvrdoća | Mineral |
|---|---|
| 1 | talk (Mg3Si4O10(OH)2) |
| 2 | gips (CaSO4·2H2O) |
| 3 | kalcit (CaCO3) |
| 4 | fluorit (CaF2) |
| 5 | apatit (Ca5(PO4)3(OH-,Cl-,F-)) |
| 6 | ortoklas feldšpar (KAlSi3O8) |
| 7 | kvarc (SiO2) |
| 8 | topaz (Al2SiO4(OH-,F-)2) |
| 9 | korund (Al2O2) |
| 10 | dijamant (C) |
molarna masa → molar mass
Molarna masa tvari (M) jest masa jednog mola njenih jedinki. SI jedinica za molarnu masu je kg mol-1 a obično se upotrebljava decimalna jedinica g mol-1.
Molarna masa je brojčano jednaka relativnoj atomskoj masi, odnosno relativnoj molekularnoj masi.
mol → mole
Mol (mol) je osnovna SI jedinica za količinu (množinu) tvari.
Mol je količina tvari onog sustava koji sadrži toliko elementarnih jedinki tvari koliko ima atoma u 0.012 kg izotopa ugljika 12 (12C).
Elementarne jedinke uvijek moraju biti specificirane i mogu biti atomi, molekule, ioni, elektroni, neke druge čestice ili određene grupe čestica. U jednom molu (0.012 kg) izotopa ugljika 12 ima 6.022 045×1023 atoma (Avogadrov broj).
monoklinski kristalni sustav → monoclinic crystal system
U monoklinskom kristalnom sustavu sve tri kristalografske osi različite su duljine. Dvije od njih (a i c) sijeku se pod šiljatim kutom i obično su smještene uspravno. Treća os (b) siječe pod pravim kutom druge dvije osi i naziva se orto os.
a ≠ b ≠ c
α = γ = 90° ≠ β
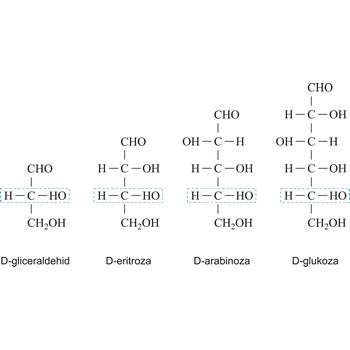
monosaharid → monosaccharide
Monosaharidi su ugljikohidrati, opće formule Cn(H2O)n, koji se hidrolizom ne mogu rastaviti na jednostavnije ugljikohidrate.
Ovisno o tome sadrže li aldehidnu (RCHO) ili keto skupinu (RCOR’) monosaharidi mogu biti polihidroksi aldehidi ili polihidroksi ketoni. Aldehidna odnosno keto skupina odgovorne su za redukcijska svojstva monosaharida. Monosaharidi se mogu podijeliti i prema broju ugljikovih atoma u ugljikovodičnom lancu pa tako imamo trioze s tri ugljikova atoma, tetroze s četiri, pentoze s pet, heksoze sa šet, heptoze sa sedam itd. Ova dva sustava podjele često se kombiniraju. Primjerice, D-glukoza, polihidroksi aldehid, je aldoheksoza a fruktoza, polihidroksi keton, je ketoheksoza.
Oznake D i L često se koriste da opišu konfiguraciju ugljikohidrata. U Fischerovoj projekcijskoj formuli, karbonilna skupina je uvijek smještena na vrh (u slučaju aldoza) ili što je moguće bliže vrhu (u slučaju ketoza). Ako se OH skupina na asimetričnom ugljikovom atomu najudaljenijem od karbonilne skupine (drugom odozdo) nalazi s desne strane imamo D-šećer, a ako je s lijeve strane, L-šećer. Uz rijetke iznimke svi šećeri u prirodi su D-šećeri.
Otvoreni lanac monosaharida može intramolekularnom ciklizacijom preći u prstenastu strukturu. Ciklizacijom nastaju dva konfiguracijska izomera, točnije dijastereomera (anomera), jer se ciklizacijom planarna karbonilna skupina pretvara u asimetrični ugljikov atom. Anomer kod kojeg je konfiguracija anomernog ugljika ista kao konfiguracija referentnog asimetričnog ugljika u Fischerovoj projekciji označava se kao α-anomer, a ako je konfiguracija različita radi se o β-anomeru.
plikavac → mustard agent
Plikavci su dobili ime zbog sličnosti rana uzrokovanih onima koje izazivaju opekline. Međutim, plikavci također uzrokuju i velika oštećenja očiju, dišnog sustava i unutrašnjih organa. Uobičajeni plikavac (iperit), 1,1-tio-bis-[2-kloroetan], reagira s velikim brojem bioloških molekula. Učinak plikavaca javlja se sa zadrškom: prvi simptomi se javljaju između 2 i 24 sata nakon izloženosti. Pri sobnoj temperaturi plikavci su tekućine niske hlapljivosti i stabilne su tijekom skladištenja.
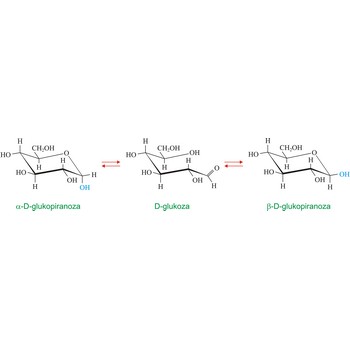
mutarotacija → mutarotation
Mutarotacija je promjena optičke aktivnosti uzrokovana epimerizacijom. U kemiji ugljikohidrata ovaj termin obično se odnosi na epimerizaciju anomernog ugljikovog atoma. U vodenoj otopini postiže se ravnotežna smjesa dvaju anomera koji prelaze jedan u drugi preko otvorenog aldehidnog oblika. Otapanjem čiste α-D-glukopiranoze ([α]D = +112.2°) ili čiste β-D-glukopiranoze ([α]D = +18.7°)u vodi dolazi do promjene zakretanja svjetlosti koje na kraju uvijek iznosi [α]D = +52.6deg;. U ravnoteži se nalazi 36 % α- i 64 % β-oblika dok je aldehidni oblik prisutan u jako niskoj koncentraciji. Mutarotaciju je 1846. otkrio francuski kemičar Augustin-Pierre Dubrunfaut (1797.-1881.).Nernstov zakon razdjeljenja → Nernst’s division law
Nernstov zakon razdjeljenja kaže da se tvar raspodjeljuje između dva otapala tako da je omjer koncentracija te tvari pri nekoj temperaturi stalan, uz uvjet da se u oba otapala tvar nalazi u istom molekularnom obliku. Koeficijent razdjeljenja odnos je koncentracija tvari u otapalima A i B na određenoj temperaturi.
Pojava razdjeljenja iskorištava se za ekstrakciju tvari.
Nernstova jednadžba za elektrodni potencijal → Nernst’s electrode potential equation
Za opću reakciju nekog redoks-sustava
ovisnost elektrodnog potencijala redoks sustava o aktivitetu oksidiranog i reduciranog oblika u otopini daje nam Nernstova jednadžba za elektrodni potencijal:
gdje je E = elektrodni potencijal redoks-sustava
E° = standardni elektrodni potencijal redoks-sustava
R = univerzalna plinska konstanta
T = termodinamička temperatura
F = Faradayeva konstanta
z = broj elektrona koji se izmjenjuju u redoks-reakciji
aO = aktivitet oksidiranog oblika
aR = aktivitet reduciranog oblika
n = stehiometrijski koeficijent oksidiranog oblika
m = stehiometrijski koeficijent reduciranog oblika
Citiranje ove stranice:
Generalić, Eni. "Clay triangle." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav