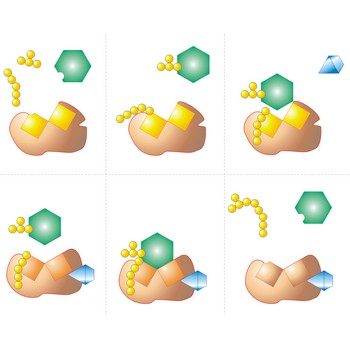
enantiomer → enantiomer
Enantiomeri ili optički izomeri jesu molekule čija se struktura ne može poklopiti, odnosno struktura jedne molekule je slika u ogledalu druge molekule.
entalpija → enthalpy
Entalpiju (H) uveo je J.W. Gibbs 1902. kao toplinsku funkciju stanja
gdje je U unutrašnja energija sustava, p je tlak a V volumen. U kemijskim reakcijama koje se odvijaju u atmosferi tlak ostaje konstantan i entalpija reakcije (ΔH) jednaka je
Za egzotermne reakcije ΔH je negativan.
entropija → entropy
Entropija (S) je termodinamička funkcija koja govori o iskoristivosti toplinske energije. Promjena entropije nekog sustava ovisi samo o početnom i konačnom stanju sustava i definirana je izrazom
Ako je sustav izoliran, njegova se entropija neće mijenjati kada se odvija reverzibilni proces, dok će rasti ako se odvija ireverzibilan (nepovratljiv) proces. Ireverzibilnost procesa mjeri se entropijom.
Najveću entropiju imaju plinovi a najmanju kristali. Prema tome, entropija se može smatrati mjerom za nered u nekom sustavu. Pri apsolutnoj nuli u savršenom kristalu entropija je jednaka nuli.
enzim → enzyme
Enzimi su biokemijski katalizatori koji po svom sastavu spadaju u grupu globularnih (klupčastih) proteina. Enzimi su specifični katalizatori i svaki enzim katalizira jednu reakciju ili skupinu srodnih reakcija. Molekule koje sudjeluju u reakciji (supstrat) veže se na specifično aktivno mjesto na molekuli enzima stvarajući kratkoživući intermedijer: to jako, ponekad i za faktor 1020 ubrzava reakciju u smjeru nastajanja produkta. Određeni enzim može sudjelovati i u sintezi i u razgradnji određene tvari.
epimer → epimer
Epimeri su dijastereoizomeri (s dva ili više kiralnih centara) koji se međusobno razlikuju po prostornom rasporedu samo na jednom kiralnom centru. Primjerice D-glukoza i D-manoza, koji se razlikuju samo po položaju OH skupine na C-2, su epimeri. D-glukoza i D-galktoza su također epimeri (razlikuju se u konfiguraciji na C-4).
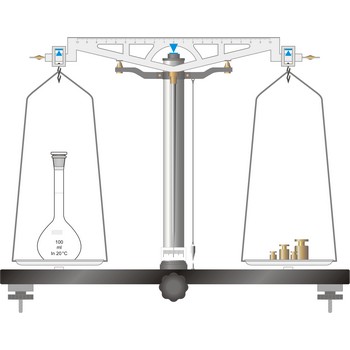
vaga s jednakim krakovima → equal-arm balance
Vaga s jednakim krakovima najjednostavniji je tip vage koji se temelji na principu poluge. Uporište (oslonac) oko koje se okreće poluga vage oštri je brid trostrane ahatne prizme koji se oslanja na ravnu pločicu od istog materijala. Na krajevima poluge, jednako udaljene od uporišta, na prizme noževe obješene su zdjelice. Točnost ove podjele, međusobni položaj prizmi i preciznost njihove obrade određuju kvalitetu vage. Na polugu vage, pod pravim kutom, učvršćena je kazaljka koja pokazuje je li vaga u ravnoteži.
Svaka vaga ima uređaj za kočenje/oslobađanje koji štiti osjetljive bridove prizmi od oštećenje, pogotovo u trenutku stavljanja i skidanja predmeta i utega s vage. Predmet koji se važe stavlja s na zdjelicu obješenu o jedan krak vage (obično lijevu) a odgovarajuća masa utega na zdjelicu obješenu o drugi krak vage. Vaga obavezno mora biti zakočena kada se predmeti ili utezi stavljaju na zdjelice.
Erlenmeyerova tikvica → Erlenmeyer flask
Erlenmeyerova tikvica je staklena posuda konusnog oblika s dugim vratom i ravnim dnom. Ime je dobila po svom izumitelju, njemačkom kemičaru Richardu Erlenmeyeru (1825.-1909.). Zbog oblika tikvice mala je opasnost od gubljenja otopine uslijed prskanja tijekom titracije ili zagrijavanja.
konstanta ravnoteže → equilibrium constant
Konstanta ravnoteže (K) prvi put se pojavljuje u zakonu o djelovanju masa koji su 1863. formulirali norveški kemičari C.M. Guldberg i P. Waage. Reverzibilna kemijska reakcija prikazana jednadžbom
u ravnoteži je onda kada je brzina napredne reakcije jednaka brzini povratne reakcije.
Konstanta ravnoteže definirana je odnosom ravnotežnih aktiviteta produkata i reaktanata
Kod praktičnih mjerenja često se aktiviteti zamjenjuju koncentracijama
Za reakcije u plinskoj fazi umjesto koncetracija upotrebljavaju se parcijalni tlakovi
Termodinamička konstanta K nema jedinicu, dok jedinica za Kp i Kc ovisi o broju molekula koje se pojavljuju u stehiometrijskoj jednadžbi (a, b, c i d).
Veličina konstante ravnoteže ovisi o temperaturi. Ako je napredna reakcija egzotermna, konstanta ravnoteže smanjuje se povećanjem temperature. Što je veća konstanta ravnoteže neke kemijske reakcije, to je ravnoteža više pomaknuta na stranu stvaranja produkata reakcije. Položaj uspostavljene ravnoteže može se mijenjati, ali ne i konstanta. Sustav u ravnoteži brani se od promjene tako da nastoji poništiti vanjski utjecaj (Le Chatelierov princip).
Konstanta ravnoteže kemijske reakcije izravno je proporcionalna promjeni standardne Gibbsove slobodne energije
eter → ether
Eteri su organski spojevi opće formule R-O-R. Dva radikala u molekuli etera mogu biti jednaka ili različita. R ne može biti vodik. Dobivaju se dehidrogenacijom alkohola sa sulfatnom kiselinom. Eteri su hlapljivi, lakozapaljivi spojevi koji, ako sadrže perokside, mogu eksplodirati pri zagrijavanju. Ime eter često se koristi kao sinonim za dietil eter.
Citiranje ove stranice:
Generalić, Eni. "Clay triangle." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav