Beerov zakon → Beer’s law
Beerov zakon (naziva se i Beer-Lambertov zakon) daje funkcijski odnos između veličine mjerene apsorpcijskom metodom (A) i veličine koja se određuje, koncentracije (c). Posljedica međudjelovanja fotona i čestica koje apsorbiraju jest smanjenje snage snopa s Po na P. Beerov zakon može se prikazati kao
gdje je A apsorbancija na danoj valnoj duljini svjetlosti, ε je molarni apsorpcijski (ekstinkcijski) koeficijent (L mol-1 cm-1), svojstven svakoj molekulskoj vrsti i ovisan o valnoj duljini svjetlosti, b je duljina puta svjetlosti kroz uzorak (cm) a c je koncentracija tvari u otopini (mol L-1).
benzen → benzene
Benzen (benzol), C6H6, najjednostavniji je aromatski ugljikovodik, lako hlapiva tekućina karakteristična mirisa, vrelišta 80 °C, netopljiva u vodi, topljiva u benzinu, alkoholu i eteru. Gori jako čađavim plamenom, a pomiješan sa zrakom stvara eksplozivnu smjesu. Pare su mu vrlo otrovne.
Njemački kemičar Friedrich August Kekulé je, 1865., predložio strukturu molekule benzena kao heksagonalni prsten koji se sastoji od šest atoma ugljika s naizmjeničnim jednostrukim i dvostrukim ugljik-ugljik vezama. Takva struktura kaže da bi benzen trebao biti vrlo reaktivan ali to nije slučaj. Mi danas znamo da je struktura benzena doista šesterokutna, kod koje su sve C-C veze jednake i čija se duljina nalazi između onih za jednostruku i dvostruku vezu. To je objašnjeno time da se π-orbitale susjednih ugljikovih atoma preklapaju i tvore delokaliziranu molekulsku orbitalu koja se proteže oko prstena, dajući mu dodatnu stabilnost i sukladno tomu smanjenu reaktivnost. To je razlog zašto se strukturna formula benzena predstavlja kao šesterokut s krugom u sredini koji predstavlja delokalizirane elektrone.
beta-čestica → beta particle
Beta-čestice su nabijene čestice s masom koja je 0.0005 mase protona. Izlijeću iz jezgre s energijom od 0 MeV do 4 MeV. Domet je beta-čestica oko 10 m ali im je sposobnost ionizacije osjetno manja od alfa-čestica.
Ako iz jezgre radioaktivnog elementa izađe beta-čestica, nastaje novi element kojem se redni broj poveća za jedan a atomska masa mu ostane nepromijenjena. Primjerice raspadom ugljika-14 nastaje dušik-14, elektron i antineutrino:
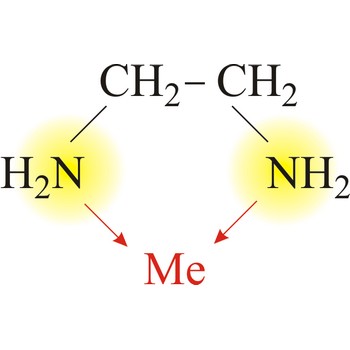
bidentatni ligand → bidentate ligand
Bidentatni ili dvozubi ligandi imaju dva donorska atoma s nepodijeljenim elektronskim parovima koji se mogu vezati s dvije koordinacijske veze na centralni atom. Primjer bidentatnog liganda je etilendiamin. Jedna molekula etilendiamina formira dvije veze s metalnim ionom. Tako se na centralni atom s kordinacijskim brojm 4 vežu dvije molekule etilendiamina a na onaj s koordinacijskim brojem 6 tri molekule.
Biot-Savartov zakon → Biot-Savart law
Magnetsko polje B vodiča kojim teče struja može se odrediti uz pomoć Biot-Savartovog zakona. Doprinos magnetskom polju na udaljenosti r od strujnog elementa IdL dan je izrazom:
u kojem je μ0 permeabilnost. Uloga permeabilnosti u magnetostatici vrlo je slična ulozi permitivnosti u elektrostatici. Da bi se odredilo ukupno magnetsko polje B (doprinos cijelog vodiča), potrebno je integrirati doprinose svih strujnih elemenata duž vodiča. Za magnetsko polje dugog ravnog vodiča kojim teče struja I, Biot-Savartov zakon daje sljedeći izraz:
SI jedinica za magnetsko polje je tesla (T).
Permeabilnost μ0 ima vrijednost 4π×10-7 T m A-1.
bizmut → bismuth
Bizmut je 1753. godine otkrio Claude Geofroy (Francuska). Ime mu dolazi od njemačkog naziva Weisse Masse - bijele nakupine što je kasnije prešlo u wismut i bisemutum. To je krhki metal srebrno-ružičasti boje. Stabilan u vodi i na zraku. Otapa se samo u koncentriranoj nitratnoj i vrućoj sulfatnoj kiselini. Toplinska vodljivost mu je najniža od svih metala, osim žive. Slab je vodič struje i ima najveći Hallov efekt od svih metala. Bizmut i njegovi spojevi su otrovni. Glavne rude bizmuta su bizmutov sjajnik (Bi2S3) i bizmutov oker (Bi2O3). Upotrebljava se kao sastojak niskotaljivih legura s olovom, kositrom i kadmijem, za izradu električnih i toplinskih osigurača. Služi kao nosač za uranijevo gorivo u nuklearnom reaktoru.
zračenje crnog tijela → blackbody radiation
Zračenje crnog tijela jest zračenje emitirano s idealnog crnog tijela, tj. tijela koje apsorbira sve zračenje koje padne na njegovu površinu. Osnovni zakon koji opisuje zračenje crnog tijela je Planckov zakon zračenja koji daje intenzitet emitiranog zračenja idealnog crnog tijela po jedinici površine u određenom smjeru kao funkciju valne duljine za određenu temperaturu. Planckov zakon može se prikazati slijedećom jednadžbom
gdje je λ valna duljina, h je Planckova konstanta, c je brzina svjetlosti, k je Boltzmannova konstanta i T je temperatura.
visoka peć → blast furnace
Visoka peć je peć koja služi u procesu dobivanja željeza iz oksidnih ruda željeza (hematita, Fe2O3 ili magnetita, Fe3O4). Koks, vapnenac i ruda ubacuju se kroz vrh peći. Vrući zrak uvodi se na dnu peći i pali koks čime se održava visoka temperatura u peći. Reakcijom između zraka i koksa razvija se ugljikov monoksid koji reducira željezov oksid.
Temperatura u peći je tolika da se rastaljeno željezo skuplja u bazi peći.
Proizvodnja željeza u visokoj peći je kontinuirani proces. Sirovine se kontinuirano ubacuju kroz vrh peći a sirovo željezo i šljaka se vade s dna. Visoka peć može raditi i do deset godina prije nego što joj se vatrostalna obloga istroši.
prostorno centrirana kubična rešetka → body-centered cubic lattice
Prostorno centrirana kubična rešetka (označava se sa bcc ili I), kao i sve ostale rešetke ima po jedan čvor kristalne rešetke u svakom uglu jedinične ćelije plus jedan dodatni čvor u sredini jedinične ćelije. Kristalografski vektori jedinične ćelije su a = b = c a kutovi među njima α=β=γ=90°.
Najjednostavnija kristalna struktura jeste ona koja ima po jedan atom u svakom čvoru jedinične ćelije. Jediničnoj ćeliji pripadaju dva atoma (8×1/8 + 1 = 2), a atomi popunjavaju 68 % volumena kocke. 23 metala kristaliziraju u kubičnom sustavu s prostorno centriranom rešetkom.
prostorno centrirana ortorompska rešetka → body-centered orthorhombic lattice
Prostorno centrirana ortorompska rešetka (označava se sa I), kao i sve ostale rešetke ima po jedan čvor kristalne rešetke u svakom uglu jedinične ćelije plus jedan dodatni čvor u sredini jedinične ćelije. Kristalografski vektori jedinične ćelije su a≠b≠c a kutovi među njima α=β=γ=90°.
Citiranje ove stranice:
Generalić, Eni. "Clay triangle." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav