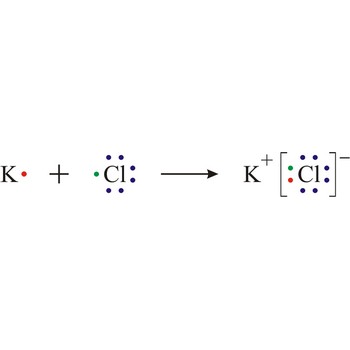globalno zatopljenje → global warming
Globalno zatopljenje ili efekt staklenika pojava je koja se zbiva u atmosferi zbog prisustva određenih plinova koji apsorbiraju infracrveno zračenje. Vidljive i ultraljubičaste zrake sposobne su prodrijeti kroz atmosferu i zagrijati Zemljinu površinu. Ovu energiju Zemlja reemitira kao infracrveno zračenje, koje zbog veće valne duljine biva apsorbirano od strane ugljikova dioksida. Posljedica toga je povećanje srednje temperature Zemlje i njene atmosfere (globalno zatopljenje). Slično se dešava i u stakleniku gdje svjetlost i duže ultraljubičaste zrake mogu proći kroz staklo ali infracrvenu radijaciju staklo apsorbira i dio reemitira u staklenik.
Ova pojava se smatra velikim rizikom i opasnošću za okoliš. Prosječno povećanje temperature može promjeniti klimu te može dovesti do otapanja ledenih polarnih kapa, a onda bi porast razine mora mogao imati katastrofične posljedice. Pokraj ugljikova dioksida, koji nastaje sagorijevanjem fosilnih goriva, negativan utjecaj na atmosferu imaju dušikovi oksidi, ozon, metan i klorofluorougljici.
glukoza → glucose
Glukoza (grožđani šećer, krvni šećer) ugljikohidrat je iz skupine monosaharida ili jednostavnih šećera kemijske formule C6H12O6. Stari naziv dekstroza potječe od toga što glukoza zakreće ravninu polarizirane svjetlosti u desno. Prema broju ugljikovih atoma u svojoj molekuli glukoza je heksoza, a prema funkcionalnoj skupini aldoza (aldoheksoza). Glukoza je najrasprostranjeniji šećer u prirodi. Slobodna se nalazi u raznom voću i medu a vezana u disaharidima (saharozi, maltozi, laktozi), polisaharidima (škrobu, glikogenu, celulozi) i raznim drugim spojevima. Kod čovjeka se može naći slobodna u krvi ili kao rezerva pohranjena u jetri i mišićima u obliku glikogena.
Glukozu sintetiziraju biljke procesom fotosinteze i pohranjuju u polimernom obliku kao škrob. U probavnom sustavu škrob se hidrolizira u glukozu koja se zatim iskorištava u stanicama za dobivanje energije. Ukupno se iz jedne molekule glukoze može dobiti 36 molekula ATP-a.
Zbog tetraedarskih kutova koje čine veze među ugljikovim atomima, molekula glukoze može zauzeti takvu konformaciju da hidroksilna skupina vezana na petom ugljikovom reagira s karbonilnom skupinom pri čemu nastaje poluacetal, odnosno šesteročlani heterociklički prsten. Time se javlja još jedan asimetrični centar na atomu C-1, tako da D-glukoza može postojati u dva oblika, kao α-D-glukopiranoza i β-D-glukopiranoza. Ta su dva ciklička oblika u ravnoteži, tj. oni mogu preći jedan u drugog preko aldehidnog oblika.
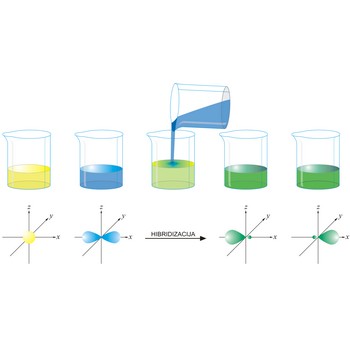
hibridne orbitale → hybrid orbital
Hibridne orbitale predstavljaju istovrsne orbitale nastale miješanjem različitih atomskih orbitala. Broj nastalih orbitala jednak je broju atomskih orbitala. Primjerice, kod sp3 hibridizacije dolazi do miješanja jedne s orbitale s tri p orbitale pri čemu nastaju četiri nove orbitale iste energije, manje od energije p ali veće od energije s orbitale.
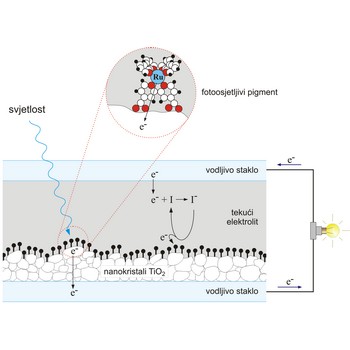
Gratzelova sunčeva ćelija → Gratzel solar cell
Grätzelova sunčeva ćelija je fotoelektrokemijska ćelija koju je razvio Michael Grätzel sa suradnicima. Oponaša djelomice prirodnu sunčevu ćeliju, koja omogućava biljkama da ostvare fotosintezu. U prirodnoj sunčevoj ćeliji molekule klorofila apsorbiraju svjetlost i to najjače u crvenom i plavom dijelu spektra, dok se zelena svjetlost reflektira. Apsorbirana energija dovoljna je za izbacivanje elektrona iz pobuđenog klorofila. U prijenosu tog naboja, sudjeluju potom druge molekule. U Grätzelovoj ćeliji su, također, za stvaranje naboja apsorpcijom svjetlosti i prijenos tog naboja "zaduženi" različiti dijelovi ćelije.
Na vodljivo staklo nanesen je sloj nanokristala poluvodiča TiO2 čija je površina jako velika. Na TiO2 nanesen je fotoosjetljivi pigment koji čine rutenijevi ioni povezani s organskim molekulama koje jako apsorbiraju vidljivu svjetlost. Fotopobuđeni elektroni prelaze s rutenijevih iona na kristalite TiO2, koji ih odvode daleko od iona-donora. Čitav sustav uronjen je u tekući jodidni elektrolit koji preuzima elektrone s elektrode i prenosi ih na rutenijeve ione kako bi se nastavio proces apsorpcije svjetlosti.
Efikasnost ovih ćelija iznosi oko 10 % i raste u difuznoj svjetlosti, tj. za oblačna vremena.
hibridizacija → hybridization
Hibridizacija atomskih orbitala je postupak u kojem se linearnim kombiniranjem valnih funkcija energijski bliskih orbitala stvaraju nove hibridne valne funkcije. Novonastale orbitale su hibridi originalnih i imaju svojstva (oblik, veličinu i energiju) koja se nalaze negdje između svojstava orbitala iz kojih su nastale.
hidrosfera → hydrosphere
Hidrosfera (iz grčkog imena za vodenu kuglu) je diskontinuirani vodeni omotač koji obuhvaća svu vodu na, ispod i iznad Zemljine površine bez obzira u kakvom se agregatnom stanju nalazi. To uključuje sve tekuće i smrznute površinske vode, podzemne vode zadržane u tlu i stijenama te vodenu paru u atmosferi. Voda neprestano kruži između ovih vodnih retencija (rezervoara) u tzv. hidrološkom ciklusu koji energiju dobiva iz Sunca.
| Vodne zalihe | V / 106 km3 | w / % |
|---|---|---|
| oceani | 1 370.0 | 97.25 |
| ledene kape i glečeri | 29.0 | 2.05 |
| podzemne vode | 9.5 | 0.68 |
| jezera i rijeke | 0.127 | 0.01 |
| vlaga u tlu | 0.065 | 0.005 |
| atmosfera (kao tekući ekvivalent vodene pare) | 0.013 | 0.001 |
| biosfera | 0.0006 | 0.00004 |
| UKUPNO | 1 408.7 | 100 |
ionska veza → ionic bond
Ionska veza predstavlja jaku silu koja drži atome zajedno u molekuli ili kristalu. Energija veze je oko 100 kJ mol-1. Ionska veza je takva veza kod koje jedan od sudionika, za vrijeme vezanja, predaje svoje nesparene elektrone drugom atomu tako da oba postignu elektronski raspored najbližeg plemenitog plina. Da bi nastala ionska veza između atoma, mora jedan od atoma prijeći u pozitivno nabijen ion gubitkom određenog broja elektrona, a drugi atom mora primiti te elektrone i prijeći u negativno nabijen ion.
Joule-Thomsonov efekt → Joule-Thomson’s effect
Temperatura idealnog plina ne mijenja se kod prigušenja na niži tlak, ali kod prigušenja realnih plinova pojavljuje se, pri višim tlakovima, veća ili manja promjena temperature. Promjena temperature koja se pojavljuje pri ekspanziji realnih plinova u sustavu u koji se ne dovodi energija naziva se Joule-Thomsonov efekt. Ustanovili su da se zraku prigušenom za 1 bar snižava temperatura za 0.25 °C. Taj je neznatni efekt, koji je za većinu tehničkih procesa posve nebitan, iskorišten je za ukapljivanje plinova.
mliječna kiselina → lactic acid
Mliječna kiselina je kiselina koja nastaje kao produkt anaerobne respiracije u mišićima i crvenim krvnim zrncima, npr. kada se umjesto kisika kao izvora energije za respiraciju koristi glikogen. Nastala mliječna kiselina u jetri se vraća u glikogen. Nakupljanje većih količina mliječne kiseline u krvi može dovesti do stresa i otrovanja. Visoke razine su obično rezultat stalne pretjerane vježbe.
zakon o očuvanju mase → law of conservation of mass
Zakon o očuvanju mase kaže da se nikakav vidljiv gubitak ni dobitak mase ne može otkriti tijekom kemijske reakcije. Stanje tvari može se promijeniti u kemijskoj reakciji, npr. iz čvrstog u plinovito, ali se ukupna masa neće promijeniti. Energija koja se oslobodi ili adsorbira tijekom kemijske reakcije rezultat je prijenosa energije između atoma i njihove okoline.
Citiranje ove stranice:
Generalić, Eni. "Activation energy." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav