Buchnerov lijevak → Buchner funnel
Büchnerov lijevak je naprava koja se koristi za vakuum filtraciju. Sastoji se od cilindričnog porculanskog lijevka (može biti i stakleni ili plastični) s perforiranom pločom na koju se stavlja ravni filtar papir. Buchnerov lijevak se stavlja na bocu za odsisavanjem a vakuum se osigurava pomoću vakuum pumpe ili vakuum sisaljke. Ime je dobio po njemačkom kemičaru Ernst Wilhelm Büchneru (1850.-1925.) koji ga je izumio 1885.
Bunsenov plamenik → Bunsen burner
Bunsenov plamenik standardni je izvor topline u laboratoriju. Faradayev izum usavršio je njemački kemičar Roberts Bunsen (1811.-1899.) za potrebe svojih radova na spektroskopiji. Bunsenov plamenik sastoji se od metalne cijevi kroz koju se usmjerava mlaz plina i postolja. Zrak se uvlači kroz otvore na dnu cijevi prekrivene prstenom kojim se regulira protok zraka. Kada prsten potpuno prekriva otvore plamenik gori žutim sigurnosnim plamenom. Uz potpuno slobodne otvore, u cijevi je dovoljno zraka i plin gori plavim plamenom koji dostiže temperature od 1 500 °C. Bunsenovim plamenikom može se zagrijava izravno plamenom ili posredno preko azbestne mrežice i vodene kupelji.
Bunsenov članak → Bunsen’s cell
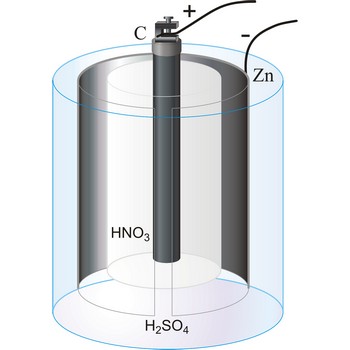
Bunsenov članak je primarni članak koji je razvio Robert W. Bunsen. Sastoji se od cinkove katode uronjene u razrijeđenu otopinu sumporne kiseline i ugljikove anode uronjene u koncentriranu otopinu dušične kiseline. Elektrolitske otopine odijeljene su poroznom stjenkom. Članak ima elektromotornu silu od 1.9 V.
bireta → burette
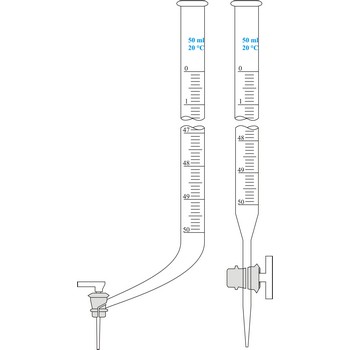
Bireta je graduirana staklena cijev koja na donjoj strani ima stakleni pipac pomoću kojeg se može ispustiti točno određena količina tekućine. Unutrašnji promjer birete mora u čitavoj dužini biti jednak jer o tome ovisi točnost mjerenja volumena. Birete se prvenstveno koriste u volumetrijskoj analizi za titraciju sa standardnom otopinom reagensa. Najčešće se koristi Schellbachova bireta od 50 mL s podjelom na 0.1 mL. Svaka bireta je kalibrirana na izljev. Za serijska određivanja upotrebljavaju se automatske birete.
kalandriranje → calendering
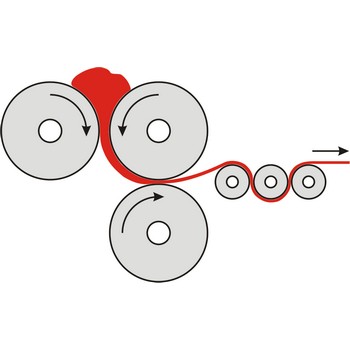
Kalandriranje je proces oblikovanja materijala u tanke filmove (foliju) njegovim provlačenjem između zagrijanih valjaka.
kalomel elektroda → calomel electrode
Kalomel elektroda referentna je elektroda temeljena na polureakciji
Tablica: Ovisnost potencijala kalomel elektrode o temperaturi i koncentraciji KCl prema standardnoj vodikovoj elektrodi
| potencijal prema SHE / V | |||
|---|---|---|---|
| t / °C | 0.1 mol dm-3 | 3.5 mol dm-3 | zasić. otop. |
| 15 | 0.3362 | 0.254 | 0.2511 |
| 20 | 0.3359 | 0.252 | 0.2479 |
| 25 | 0.3356 | 0.250 | 0.2444 |
| 30 | 0.3351 | 0.248 | 0.2411 |
| 35 | 0.3344 | 0.246 | 0.2376 |
kalorimetar → calorimeter
Kalorimetar je uređaj za određivanje količine topline koja se oslobađa ili troši tijekom neke kemijske reakcije. Služi i za određivanje specifične topline.
kondenzator → capacitor
Naprava koja pohranjuje električne naboje. Simbol za kondenzator u shemama strujnih krugova je —| |—.
ugljikohidrat → carbohydrate
Ugljikohidrati su polihidroksi aldehidi ili ketoni, ili spojevi koji hidrolizom daju takve spojeve. Često se upotrebljava i naziv saharidi, naziv izveden od latinskog naziva za šećer - saccharum). Ugljikohidrati su najraširenija klasa organskih spojeva i čine više od 50 % Zemljine suhe biomase. Sva hrana koju trošimo svoje porijeklo vuče iz biljaka koje, procesom fotosinteze, iz ugljikovog dioksida i vode stvaraju jednostavne šećere (glukozu). Složeniji ugljikohidrati, kao što su celuloza i škrob, nastaju iz glukoze. Klorofil u biljkama apsorpcijom Sunčeve svjetlosti dobiva energiju neophodnu za sintezu ugljikohidrata
U vrijeme kad još nije bila poznata njihova struktura ugljikohidrate se smatralo spojevima ugljika i vode što se moglo izraziti općom formulom Cx(H2O)y. Kasnija istraživanja pokazala su da ovi spojevi nisu hidrati ali ime je ostalo.
Ugljikohidrati se mogu podijeliti u dvije skupine: na jednostavne šećere (monosaharide), koji se ne mogu rastaviti na manje jedinice djelovanjem razrijeđene kiseline, i na složene šećere koji su sastavljeni od dvaju (disaharidi) ili više (oligosaharidi i polisaharidi) monosaharida povezanih acetalnom (glikozidnom) vezom. Složeni šećeri se hidrolizom mogu rastaviti na jednostavne šećere.
ugljik → carbon
Ugljik je poznat od davnih vremena. Ime mu potječe od latinskog naziva za ugljen - carbo. Lako izgara u prisustvu oksidansa. Javlja se u više alotropskih modifikacije, kao amorfni, grafit, dijamant i fulleren. Prirodni amorfni ugljik su razne vrste ugljena, koks i čađa. Grafit je crna, klizava krutina bez mirisa, visokog tališta i dobre električne vodljivosti. Ne tali se već sublimira na 3825 °C. Najviše se upotrebljava za proizvodnju elektroda. Dijamant je prozirna ili obojena, ekstremno tvrda krutina visokog indeksa loma. Ne vodi električnu struju a upotrebljava se kao drago kamenje i za izradu bušilica i bruseva. Četvrta alotropska modifikacija ugljika, fullerene (sačinjavaju je 60 ili 70 atoma vezanih zajedno), otkrivena je 1969. godine sublimacijom pirolitičkog grafita na niskom tlaku. U zraku dolazi kao CO2 a u stijenama kao karbonat. U prirodi se nalazi u velikim količinama kao mineralni ugljen, nastao procesom pougljenjivanja. Suhom destilacijom ugljena proizvodi se koks. Koks se upotrebljava kao redukcijsko sredstvo u metalurgiji, naročito pri proizvodnji željeza. Čađa se upotrebljava kao boja i kao punilo u proizvodnji automobilskih guma. Aktivni ugljen ima veliku površinu i upotrebljava se kao adsorbens.
Citiranje ove stranice:
Generalić, Eni. "Visoka peÃâ¡." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav