sp hibridna orbitala → sp hybrid orbital
sp hibridna orbitala jest orbitala nastala linearnom kombinacijom jedne s i jedne p orbitale usporedive energije (kao što su 2s i 2p orbitale) u istom atomu. Dvije sp hibridne orbitale linearno su simetrične i usmjerene u suprotnom smjeru, tj. međusobno zatvaraju kut od 180°. Preostale dvije nehibridizirane p orbitale i sp hibridne orbitale međusobno su okomite.
sp2 hibridna orbitala → sp2 hybrid orbital
sp2 hibridna orbitala jest orbitala nastala linearnom kombinacijom jedne s i dvije p orbitale usporedive energije (kao što su 2s i 2p orbitale) u istom atomu. Tri sp2 hibridne orbitale leže u istoj ravnini i međusobno zatvaraju kut od 120°. Nehibridizirana treća p orbitala stoji okomito na ravninu sp2 hibridnih orbitala.
sp3 hibridna orbitala → sp3 hybrid orbital
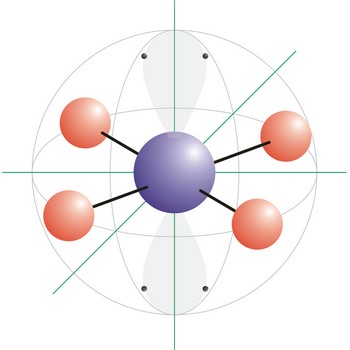
sp3 hibridna orbitala jest orbitala nastala linearnom kombinacijom jedne s i tri p orbitale usporedive energije (kao što su 2s i 2p orbitale) u istom atomu. Četiri sp3 hibridne orbitale usmjerene su prema uglovima tetraedra i međusobno zatvaraju kut od 109.5°.
spektrofotometar → spectrophotometer
Spektrofotometar je instrument koji služi za mjerenje količine svjetla koju apsorbira uzorak.
Apsorpcija svjetlosti kroz otopine može se matematički opisati Beer-Lambertovim zakonom
gdje je A apsorbancija na danoj valnoj duljini svjetlosti, ε je molarni apsorpcijski (ekstinkcijski) koeficijent (L mol-1 cm-1), svojstven svakoj molekulskoj vrsti i ovisan o valnoj duljini svjetlosti, b je duljina puta svjetlosti kroz uzorak (cm) a c je koncentracija tvari u otopini (mol L-1).
spin → spin
Spin je unutrašnji kinetički moment osnovne čestice, ili sustava čestica kao što je npr. jezgra. Također je odgovoran za magnetski moment čestice. Spinovi jezgara imaju karakteristične fiksne vrijednosti. Parovi neutrona i protona poredaju se tako da se njihovi spinovi ponište, tako da će jezgre s neparnim brojem neutrona i/ili protona imati kvantni nuklearni spinski broj različit od nule.
Stern-Gerlachov su 1921. ustanovili da se utjecajem nehomogenoga magnetskog polja na mlaz atoma srebra ovaj cijepa u dva snopa, jedan paralelan a drugi antiparalelan magnetskom polju.
kvadratna planarna geometrija molekule → square planar molecular geometry
Kvadratna planarna geometrija molekule onaj je oblik molekule kod kojeg su četiri veze i dva slobodna elektronska para vezani na centralni atom molekule. Ksenonov tetraflurid (XeF4) primjer je kvadratne građe molekule. Nepodijeljeni elektronski parovi smještaju se u dva nasuprotna vrha oktaedra a fluorovi atomi u preostala četiri tvoreći kvadrat oko ksenona. Oktaedarski raspored elektronskih orbitala posljedica je sp3d2 (ili d2sp3) hibridizacije na centralnom atomu.
kvadratna piramidalna geometrija molekule → square pyramidal molecular geometry
Kvadratna piramidalna geometrija molekule onaj je oblik molekule kod kojeg su pet veza i jedan slobodan elektronski par vezani na centralni atom molekule. Bromov pentafluorid (BrF5) primjer je molekule koja ima geometriju kvadratne piramide. Smještaj nepodijeljenog elektronskog para potpuno je proizvoljan jer su svih šest elektronskih skupina ekvivalentne. Oktaedarski raspored elektronskih orbitala posljedica je sp3d2 (ili d2sp3) hibridizacije na centralnom atomu.
standardna devijacija → standard deviation
Standardna devijacija (σ) je statistički pojam koji označava mjeru raspršenosti podataka u skupu. Interpretira se kao prosječno odstupanje od prosjeka i to u apsolutnom iznosu.
Pretpostavimo da smo izvršili velik broj mjerenja neke veličine, koja su vrlo slična, kao što je, na primjer, promjer zrna graška u mahuni. Ako bi se grafički prikazao broj očitanja za svaki promjer, najvjerojatnije bi se dobila zvonolika krivulja, s vrlo malo očitanja velikih i malih zrna, a s većinom očitanja u blizini srednje vrijednosti. Oko dvije trećine mjerenja naći će se u intervalu koji "razapinje" standardna devijacija, mjera rasprostranjenosti.
standardna vodikova elektroda → standard hydrogen electrode
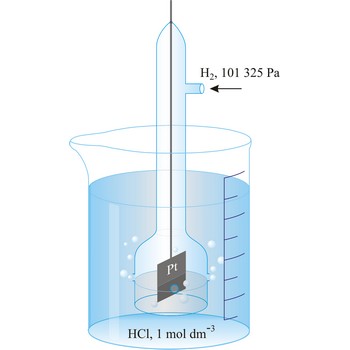
Standardna vodikova elektroda sastoji se od elektrode od spužvaste platine uronjene u otopinu vodikovih iona aktiviteta 1 kroz koju se propušta plinoviti vodik pod tlakom od 101 325 Pa. Standardna vodikova elektroda u članku dogovorno se prikazuje uvijek lijevo
Redoks-potencijal standardne vodikove elektrode, pri svim temperaturama, dogovorno je uzet kao 0.
agregatno stanje → state of matter
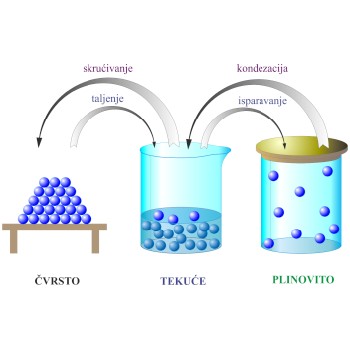
Agregatno stanje je naziv za oblike u kojima se može pojaviti materija. Razlikuju se tri agregatna stanja: čvrsto, tekuće i plinovito. Zagrijavanjem prelazi čvrsta tvar na temperaturi tališta u tekućinu. Zagrijavamo li tekućinu i dalje, na temperaturi vrelišta ona prelazi u plinovito stanje - paru.
Citiranje ove stranice:
Generalić, Eni. "Visoka peÃâ¡." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav