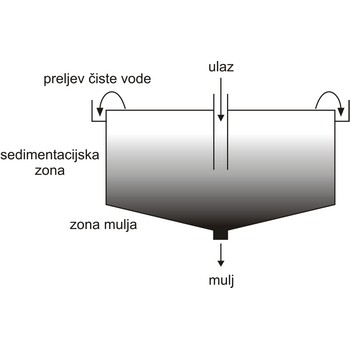
sedimentiranje → sedimentation
Sedimentiranje je postupak odjeljivanja specifično teže suspendirane tvari od otopine. Čvrsta tvar se slegne na dno a tekućina se iznad nje odlije (dekantira). Sedimentacijska zona zauzima najveći dio sedimentacijskog bazena. To je mirno područje u kojem se čestice talože. Na dnu bazena je kompresijska zona u kojoj se skuplja mulj prije uklanjanja na odlagalište ili daljnju obradu.
selenij → selenium
Selenij je 1817. godine otkrio Jons Jakob Berzelius (Švedska). Ime je dobio po grčkom nazivu za Mjesec - selene. To je amorfna ili kristalična crvena do siva krutina neugodnog mirisa koji se upije u kožu i teško odstranjuje. Ne reagira s vodom. Topljiv u alkalijama i nitratnoj kiselini. Gori na zraku. Metalni selenij je slab vodič električne struje, ali mu se vodljivost na svjetlu povećava i do tisuću puta. Selenij je otrovan ako se udiše ili proguta i ima kumulativni efekt. Nadražuje kožu i vjerojatno je kancerogen. Selenij je redoviti pratitelj sumpora. Dobiva se kao sporedni proizvod pri proizvodnji bakra (prženjem sulfidnih ruda). Upotrebljava se za izradu fotoelektričnih ćelija (osobito za fotokopiranje), u staklarskoj industriji za uklanjanje zelene boje i proizvodnji gume.
silicij → silicon
Silicij je 1824. godine otkrio Jöns Jacob Berzelius (Švedska). Ime je dobio po latinskom nazivu za kremen - silicis. Amorfni silicij je smeđe-crni prah, a kristalni je plavo-zelen. U kiselinama, osim fluoridne, se ne otapa ali se otapa u lužinama pri čemu se oslobađa vodik. Duže udisanje silikatnog praha može dovesti do kronične bolesti dišnog sustava. Silicij je drugi metal po rasprostranjenosti u Zemljinoj kori. Vezan s kisikom glavni je sastojak stijena i u njima se nalazi u obliku različitih silikata, ili kao čisti SiO2 - kremen. Kremeni pijesak je osnovna sirovina za proizvodnju stakla. Silicij se u metalurgiji upotrebljava za proizvodnju ferosilicija, a u elektronici za proizvodnju poluvodiča.
srebro → silver
Srebro je poznato od davnih vremena (~3000. godine prije Krista). Ime je dobilo po latinskoj riječi argentum što znači bijel, sjajan. To je bijeli metal visokog sjaja, neobično kovak i rastezljiv. Najbolji je vodič topline i električne struje od svih metala. Na zraku ne oksidira, ali nakon nekog vremena potamni zbog reakcije s tragovima sumporvodika u zraku pri čemu nastaje crni sulfid. Topljiv je samo u oksidirajućim kiselinama, kao što su vruća koncentrirana sulfatna i nitratna kiselina. Srebrni ion ima baktericidno djelovanje pa voda u srebrnoj posudi dugo ostaje svježa. Srebro se u prirodi može naći elementarno ili u obliku argenita (Ag2S). Uglavnom se dobiva kao nusproizvod pri proizvodnji olova i bakra. Služi za posrebrivanje manje plemenitih metala, za izradu ogledala i fotografskih filmova. Od srebra se izrađuje nakit i legure sa zlatom i bakrom.
jednostavna kubična rešetka → simple cubic lattice
Jednostavna ili primitivna kubična rešetka (označava se sa sc ili P) ima po jedan čvor kristalne rešetke u svakom uglu jedinične ćelije. Kristalografski vektori jedinične ćelije su a = b = c a kutovi među njima α=β=γ=90°.
Najjednostavnija kristalna struktura jeste ona koja ima po jedan atom u svakom čvoru jedinične ćelije. Jediničnoj ćeliji pripada jedan atom (8×1/8 = 1), a atomi popunjavaju 52 % volumena kocke. Samo jedan metal (α-polonium) kristalizira u kubičnom sustavu s jednostavnom rešetkom.
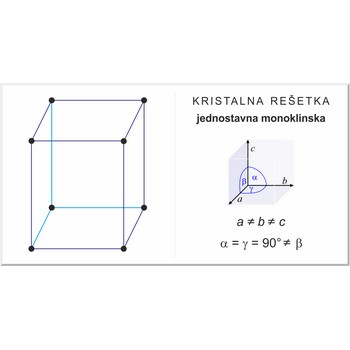
jednostavna monoklinska rešetka → simple monoclinic lattice
Jednostavna ili primitivna monoklinska rešetka (označava se sa P) ima po jedan čvor kristalne rešetke u svakom uglu jedinične ćelije. Kristalografski vektori jedinične ćelije su a≠b≠c a kutovi među njima α=γ=90°≠β.
jednostavna ortorompska rešetka → simple orthorhombic lattice
Jednostavna ili primitivna ortorompska rešetka (označava se sa P) ima po jedan čvor kristalne rešetke u svakom uglu jedinične ćelije. Kristalografski vektori jedinične ćelije su a≠b≠c a kutovi među njima α=β=γ=90°.
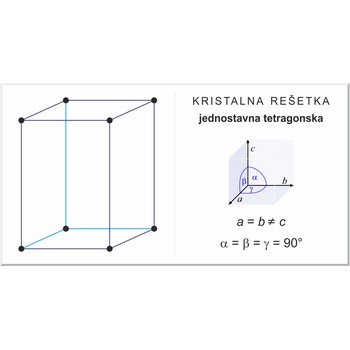
jednostavna tetragonska rešetka → simple tetragonal lattice
Jednostavna ili primitivna tetragonska rešetka (označava se sa P) ima po jedan čvor kristalne rešetke u svakom uglu jedinične ćelije. Kristalografski vektori jedinične ćelije su a=b≠c kutovi među njima α=β=γ=90°.
sol → sol
Solovi su disperzije čvrstih čestica u tekućini. Ove čestice mogu biti makromolekule ili nakupine malih molekula. Liofobni solovi su takvi solovi kod kojih ne postoji afinitet između dispergirane faze i tekućine (npr. srebrov klorid u vodi). Liofobni solovi su po prirodi nestabilni i s vremenom koaguliraju i istalože se. Liofilni solovi, u drugu ruku, mnogo su sličniji pravim otopinama. Stabilni su i teško se koaguliraju (npr. škrob u vodi).
sunčeva ćelija → solar cell
Sunčeva ili fotonaponska ćelija jest naprava koja sunčevu svjetlost pretvara u elektricitet. Sve sunčeve ćelije koriste se fotonaponskom pojavom, pa se često zovu fotonaponskim napravama. U većini ovih ćelija osnovni materijal čine poluvodiči, a najčešći je silicij.
Fotonaponska pojava zasniva se na stvaranju pokretnih nositelja naboja - elektrona i šupljina - uslijed apsorpcije fotona svjetlosti. Ovaj par naboja stvara se kad elektron u najvišoj popunjenoj elektronskoj vrpci poluvodiča (valentnoj vrpci) apsorbira foton dostatne energije i prijeđe u praznu elektronsku vrpcu (vodljivu vrpcu). Ovo pobuđenje može se inducirati samo fotonom čija energija odgovara širini energijskog procjepa koji razdvaja valentnu i vodljivu vrpcu. Stvaranje para naboja elektron-šupljina može se pretvoriti u električnu struju u poluvodičkoj napravi, u kojoj je sloj jednog poluvodiča spojen sa slojem drugačijeg poluvodiča ili pak metala. U većini poluvodičkih ćelija ovaj je spoj takozvani p-n spoj, tj. sučeljavaju se p-dopirani i n-dopirani poluvodič. Na sučelju višak pozitivnog naboja (šupljina) u p-dopiranom poluvodičkom sloju i višak negativnog naboja (elektrona) u n-dopiranom poluvodičkom sloju stvara električno polje, koje se prostire s obje strane sučelja. Kad se apsorpcijom fotona u ovom području stvori par elektron-šupljina, ovi naboji se, zbog djelovanja polja, udaljuju od sučelja krećući se u suprotnim smjerovima prema vrhu i dnu ćelije, gdje se nalaze metalne elektrode za skupljanje struje. Elektroda na vrhu (kroz koju se apsorbira svjetlost ) podijeljena je na trake tako da ne zaklanja poluvodički sloj. U većini komercijalnih ćelija p-n spoj se formira unutar monolitnog komada kristalnog silicija. Silicij apsorbira sunčevu svjetlost onih valnih duljina pri kojima je najintenzivnija, od bliskog infracrvenog područja (valnih duljina oko 1200 nm) do ljubičastog (valnih duljina oko 350 nm).
Citiranje ove stranice:
Generalić, Eni. "Tekući kristal." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav