stalna tvrdoća → permanent hardness
Stalna tvrdoća vode potječe od sulfata, klorida ili nitrata kalcija i magnezija. Ove soli su štetne jer se talože kao kamenac na zagrijanim površinama kotlova i cijevi. Nastali kamenac sužava promjer cijevi smanjujući protok vode ili uzrokujući potpunu blokadu cijevi. Ovo se dešava u svim cijevima s toplom vodom.
elektrodijaliza → electrodialysis
Elektrodijaliza je postupak dijalize ubrzan djelovanjem električnog polja. Dijalizator je podijeljen u tri dijela. Otopina koja se dijalizira teče kroz srednji odjeljak, između dviju polupropusnih membrana za pozitivne i negativne ione. Elektrode su smještene u pokrajnje odjeljke. Pod utjecajem električnog polja pozitivni ioni putovat će prema katodi (negativnoj elektrodi), a negativni ioni prema anodi (pozitivnoj elektrodi) čime se ubrzava putovanje iona kroz membranu. Tijekom dijalize čista voda nakuplja se uz elektrode a između membrana ostaje slana.
jednostavna sol → plain salt
Jednostavna sol je sol koja sadrži samo ion metala (ili amonijev ion) i kiseli radikal; nastaje kad su svi ioni vodika u kiselini zamijenjeni ionima metala (ili amonijevim ionima).
plastični sumpor → plastic sulphur
Plastični sumpor oblik je sumpora koji nastaje kada se vrući, tekući sumpor izlije u vodu. Može se rastezati u duga vlakna, nestabilan je i lako se stvrdnjava.
polivalentni elementi → polyvalent element
Polivalentni elementi se definiraju s brojem atoma monovalentnog elementa s kojima se spaja jedan atom dotičnog elementa. Tako je kisik u vodi dvovalentan (H2O), dušik u amonijaku trovalentan (NH3), ugljik u metanu četverovalentan (tetravalentan) (CH4).
primarni alkohol → primary alcohol
Primarni alkoholi su alkoholi na kojima je hidroksidna grupa vezana za primarni ugljikov atom. Opća strukturna formula primarnih alkohola je RCH2OH gdje R predstavlja atom vodika ili alkilnu skupinu.
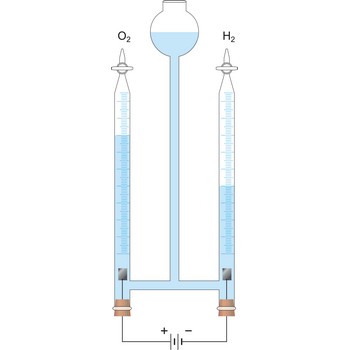
elektroliza → electrolysis
Elektroliza je elektrokemijski proces pri kojem se uz pomoć vanjskog izvora struje na elektrodama (katodi i anodi) vrše reakcije oksidacije i redukcije.
elektroliti → electrolytes
Elektroliti su tvari koje rastaljene ili otopljene u vodi provode električnu struju. Taljenjem ili otapanjem disociraju na električki nabijene čestice (ione) koje provode električnu struju. Pri prolazu električne struje dolazi do prijenosa materije. Pozitivno nabijene čestice (kationi) putuju prema negativnom polu (katodi) a negativno nabijene čestice (anioni) putuju prema pozitivnom polu (anodi). Tekući metali obično se ne smatraju elektrolitima. Krute ionske vodiče (npr. natrijev sulfid) također ubrajamo u elektrolite. Ovisno o tome kako provode električnu struju tvari možemo podijeliti na jake elektrolite, slabe elektrolite i neelektrolite.
elektronegativnost → electronegativity
Elektronegativnost je snaga kojom atom pojedinog elementa privlači elektrone. Primjerice, u klorovodiku atom klora je mnogo negativniji od atoma vodika i molekula je polarna, s negativnim nabojem na atomu klora. Elementi s velikom elektronegativnošću lako tvore negativne ione.
L. Pauling je, određivanjem energije kemijske veze, dao svoju skalu relativnih elektronegativnosti. Na toj skali fluor ima najveću elektronegativnost (4), a francij najmanju (0.7).
Što atom ima veću elektronegativnost, to jače privlači elektrone, a što je veća razlika u elektronegativnosti između elemenata, to je veći stupanj ionskog karaktera veze između njihovih atoma. Kad je razlika u relativnoj elektronegativnosti 1.9, udio je ionskog karaktera veze oko 50 %.
eter → ether
Eteri su organski spojevi opće formule R-O-R. Dva radikala u molekuli etera mogu biti jednaka ili različita. R ne može biti vodik. Dobivaju se dehidrogenacijom alkohola sa sulfatnom kiselinom. Eteri su hlapljivi, lakozapaljivi spojevi koji, ako sadrže perokside, mogu eksplodirati pri zagrijavanju. Ime eter često se koristi kao sinonim za dietil eter.
Citiranje ove stranice:
Generalić, Eni. "Standardna prosječna oceanska voda." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav