vodikova veza → hydrogen bond
Vodikova veza formira se između atoma vodika i nekog elektronegativnog atoma te se označava isprekidanom crticom H-X---H-B. U molekuli vode dva su vodikova atoma međusobno tako raspoređena da zatvaraj kut od 105°. Svaki atom vodika ima slab pozitivan naboj a kisik negativan. Nastali dipoli uzajamno se elektrostatski privlače. Vodikova veza jaka je otprilike kao jedna desetina σ-veze a dvostruko je duža od nje.
jod → iodine
Jod je 1811. godine otkrio Bernard Courtois (Francuska). Ime mu dolazi od grčke riječi ioeides za ljubičastu boju zbog karakteristične boje njegovih para. To je sjajna, ljubičasto-crna krutina karakterističnog mirisa koja lako sublimira. Jod se slabo otapa u vodi, ali se dobro otapa u alkoholu. Pare joda su otrovne. Jod izaziva opekline na koži. U prirodi se nalazi u obliku jodida i jodata. Dobiva se iz čilske salitre ili iz pepela morskih algi. Upotrebljava se u organskoj sintezi, dezinfekciju i kao preventivno sredstvo protiv gušavosti (dodatak prehrani).
nemetal → non-metal
Nemetali su elementi koji ne pokazuju metalna svojstva (slabi su vodiči topline i električne struje, ne daju se kovati itd.). Njihove se molekule uglavnom sastoje od kovalentno vezanih atoma osim kod idealnih plinova koji su monoatomni.
Smješteni su skroz desno u periodnom sustavu. Oksidi nemetala otapanjem u vodi daju kiseline. Nemetali imaju skoro popunjenu vanjsku ljusku s elektronima i lako se spajaju jedan s drugim ili s metalima. Kod mnogih elemenata ove grupe susrećemo alotropiju.
fenilalanin → phenylalanine
Fenilalanin je hidrofobna aminokiselina s aromatskim pobočnim lancem. Zbog svoje velike hidrofobnosti jako je slabo topljiv u vodi i obično se smješta u unutrašnjost bjelančevina. Ovaj lanac nije reaktivan ali igra važnu ulogu u stabiliziranju bjelančevina svojim hidrofobnim interakcijama. Fenilalanin je esencijalna aminokiselina koju ljudski organizam ne može sintetizirati te se mora unijeti preko hrane.
- Kratice: Phe, F
- IUPAC ime: 2-amino-3-fenilpropanska kiselina
- Molekularna formula: C9H11NO2
- Molekularna masa: 165.19 g/mol
Knudsenova bireta → Knudsen burette
Knudsenova bireta s automatskom nulom osmislio je danski fizičar Martin Knudsen (1871.-1949.) kako bi se i pri rutinskim terenskim analizama u brodskom laboratoriju ostvarila visoka točnost mjerenja. Bireta se puni otopinom srebrovog nitrata iz rezervoara R smještenog iznad birete otvaranjem ventila A. Kada otopina pređe trokraki ventil C prekine se dotok otopine (zatvaranjem ventila A). Eventualni višak otopine hvata se u posudu W. Okrene se trokraki ventil C, koji ujedno označava nulu na skali, kako bi atmosferski zrak mogao ulaziti u biretu. Budući da većina oceanskih uzoraka leži u relativno uskom rasponu kloriniteta, bireta je osmišljena tako da se većina njenog kapaciteta nalazi u proširenju na vrhu (B). To omogućava da titracija bude brza (brzim ispuštanjem sadržaja proširenja B) a smanjuje se i pogreška nastala cijeđenjem otopine niz stjenku birete.
Svaki mililitar podijeljen je na dvadeset dijelova (tzv. podjela na dvostruke mililitre Knudsenove birete) čime se postiže velika preciznost mjerenja (skala se lako očitava do preciznosti od 0.005 mL). Od 0 do 16 bireta nema podjelu, ona obično počinje od 16 i ide do 20.5 ili 21.5. Jedan dvostruki mililitar na skali Knudsenove birete odgovara jednom promilu klorida u uzorku mora. Ova bireta se može koristiti za titriranje vode svih oceana i svih mora, s izuzetkom onih vrlo niske slanosti (npr. Baltičkog mora) i ušća rijeka, koji zahtijevaju korištenje običnih bireta.
otrov → poison
Otrovi su tvari koje kontaktom ili unošenjem u organizam slabe ili onemogućavaju normalne metaboličke procese i tako mijenjaju normalno funkcioniranje organa ili tkiva
Otrovi su tvari ili molekule koje se skupljaju na površini katalizatora i time blokiraju pristup aktivnim centrima ili uništavaju njihovu aktivnost.
Otrovi su tvari koje apsorbiranjem neutrone i time smanjuju nuklearnu reakciju. Prevelika količina otrova može potpuno zaustaviti lančanu reakciju.
polonij → polonium
Polonij je 1898. godine otkrila Marie Curie (Poljska). Ime je dobio u čast Poljske, domovine Marie Curie-Sklodowske (1867.-1934.). To je srebrno-sivi polumetal koji jako isparava na zraku. Lako se otapa u razrijeđenim kiselinama, a slabo u lužinama. Radioaktivnim raspadom isijava plavu svjetlost. Polonij je radioaktivan. To je jaki otrov koij je izrazito radiotoksičan i kancerogen. Polonij se u prirodi javlja u uranovim rudama. Ima ga otprilike sto mikrograma na tonu rude. Nastaje kao produkt radioaktivnog raspada drugih elemenata. Raspada se uz emisiju alfa-čestica, a kako se skoro sve alfa čestice zaustavljaju na zidovima posude, dajući energiju, polonij se koristi za izradu termoelektričnih nuklearnih baterija.
praktični salinitet → practical salinity
Praktični salinitet (praktična slanost), označen kao SP, definirao je JPOTS 1978. Skala praktičnog saliniteta (Practical Salinity Scale 1978, PSS-78) definirana je preko K15, odnosno odnosa električne vodljivosti uzorka mora pri t68 = 15 °C i tlaku od jedne standardne atmosfere i otopine kalijevog klorida (KCl) u kojoj je maseni udio KCl točno 0.0324356 (32.4356 g KCl otopljeno je u 1 kg otopine) pri istom tlaku i temperaturi. Praktični salinitet je bezdimenzijska veličina iako mu ponekad (pogrešno) pripisuju jedinicu "psu". Po definiciji, K15 iznosi točno 1 kada je praktični salinitet jednak 35 (pri gornjim uvjetima vodljivost obje otopine je C(35,1568,0) = 42.914 mS/cm = 4.2914 S/m). Praktični salinitet definiran je slijedećom jednadžbom koja vrijedi za slanosti od 2 do 42:
Kod mjerenja pri temperaturama i tlakovima (dubinama) različitim od standardnih računa se odnos vodljivosti R koji se može prikazati kao produkt tri faktora označena s Rp, Rt i rt:
Za svaku temperaturu različitu od t68 = 15 °C Praktični salinitet dan je kao funkcija od Rt (pri čemu je k = 0.0162). Pri temperaturi t68 = 15 °C Rt postaje K15.
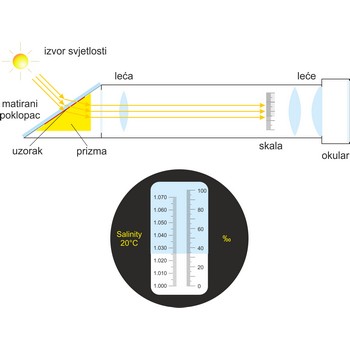
refraktometar → refractometer
Refraktometar je optički uređaj za mjerenje indeksa loma. Refraktometar iskorištava činjenicu da se svjetlost različito lomi dok prolazi kroz različite materijale. Može se koristiti za mjerenje saliniteta morske vode ili količine sladora u grožđu. Refraktometri se mogu nabaviti sa ili bez automatske temperaturne kompenzacije (ATC).
Salinitet se refraktometrom mjeri tako da se uzorak stavi na optičku prizmu ispod matiranog poklopca. Svjetlost prolazi kroz uzorak i lomi se ovisno o količini soli u njemu bacajući sjenu na skalu uređaja. Salinitet se kroz okular očita izravno sa skale refraktometra.
renij → rhenium
Renij su 1925. godine otkrili Walter Noddack, Ida Tacke i Otto Berg (Njemačka). Ime je dobio od latinskog naziva za rijeku Rajnu - Rhenus. Mendeljejev ga je predvidio 1871. i dao mu ime dvimangan. To je srebrno-bijeli metal velike gustoće. Dobiva se kao sivi prah. Potamni kada stoji u vlažnom zraku. Otporan je na koroziju u slanoj vodi i oksidaciju. Topljiv je u nitratnoj i sulfatnoj kiselini ali ne i u kloridnoj. U prirodi se može naći u gadolinitu, molibdenitu, kolumbitu i nekim sulfidnim rudama ali se nigdje na javlja u koncentracijama većim od 50 ppm. Upotrebljava se kao dodatak volframovim i molibdenovim legurama. Re-Mo legura pokazuje supervodljivost na 10 K. Re-W termopar može mjeriti temperature do 2200 °C.
Citiranje ove stranice:
Generalić, Eni. "Slab dummy etabs." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav