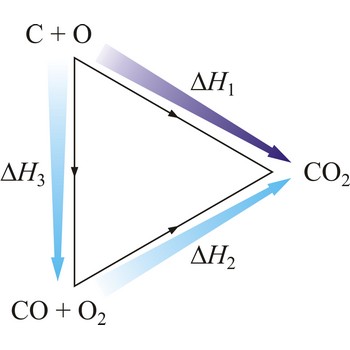
Hessov zakon → Hesse’s law
Zakonitost termokemijskih pojava otkrio je 1840. ruski kemičar švicarskog porijekla Germain Henri Hess (1802.-1850.). Njegov zakon glasi: Reakcijska toplina neke kemijske promjene ne ovisi o putu kojim reakciju vodimo, već samo o početnom i konačnom stanju sustava. Hessov zakon poznat je i kao zakon o stalnosti zbroja toplina reakcije.
Na primjer, eksperimentalno je određena entalpija oksidacije grafita u ugljikov dioksid i ugljikova monoksida u ugljikov dioksid. Zbog ravnoteže
nije moguće odrediti entalpiju oksidacije grafita u ugljikov monoksid. Međutim, reakcijska toplina te reakcije može se izračunati primjenom Hessovog zakona.
| C(s) + O2(g) →← CO2(g) | ΔrH1 = -393 kJ mol-1 |
| CO(g) + 1/2O2(g) →← CO2(g) | ΔrH2 = -283 kJ mol-1 |
| C(s) + 1/2O2(g) →← CO(g) | ΔrH3 = -110 kJ mol-1 |
homologni niz → homologous series
Homologni niz je niz spojeva zajedničke opće formule u kojem se svaki član od idućeg razlikuje za istu skupinu, npr. metilensku skupinu (-CH2-). Članovi homolognog niza zovu se homolozi.
Ravnolančani alkani primjer su homolognog niza opće formule CnH2n+2
| Struktura | Ime |
|---|---|
| CH4 | metan |
| CH3-CH3 | etan |
| CH3-CH2-CH3 | propan |
| CH3-CH2CH2CH3 | butan |
| CH3-(CH2)3-CH3 | pentan |
| CH3-(CH2)4-CH3 | heksan |
| CH3-(CH2)5-CH3 | heptan |
| CH3-(CH2)6-CH3 | oktan |
| CH3-(CH2)7-CH3 | nonan |
| CH3-(CH2)8-CH3 | dekan |
hidrofobne interakcije → hydrophobic interaction
Hidrofobne interakcije su tendencija ugljikovodika (ili ugljikovodicima sličnim skupinama u otopinama) da stvaraju intermolekularne nakupine u vodenoj sredini, i analogne intramolekularne interakcije. Ime je nastalo od pojave "mržnje" između vode i ugljikovodika. Ne preporučuje se upotreba zbunjujućeg alternativnog izraza hidrofobna veza.
indikatorska elektroda → indicator electrode
Indikatorska elektroda je radna elektroda u nekim klasičnim dvoelektrodnim sustavima, npr. u potenciometriji. Potencijal indikatorske elektrode u odnosu na referentnu elektrodu posljedica je koncentracije (točnije aktiviteta) ispitivane vrste u otopini.
ionski izmjenjivač → ion exchanger
Ionski izmjenjivači su visokopolimerni spojevi koji imaju svojstvo da vežu ione iz otopine, a pri tome oslobađaju ekvivalentnu količinu istoimeno nabijenih iona. Ion izmjenjivačke smole sadrže različite kopolimere čvrsto vezane u trodimenzionalanu strukturu na koju su pričvršćene ionske skupine. Ovisno o strukturi imamo kationske i anionske izmjenjivače. Upotrebljavaju se za prečišćavanje različitih otopina, lijekova, demineraliziranje vode i dr.
iridij → iridium
Iridij je 1803. godine otkrio Smithson Tennant (Engleska). Ime je dobio po latinskoj riječi iris što znači duga jer su mu spojevi jako obojeni. To je sjajni, vrlo tvrdi, srebrni metal. Zajedno s osmijem i platinom čini skupinu teških platinskih metala. Ni jedna vodena otopina ga ne napada. Razara ga tek rastaljena lužina. Na zraku se nezaštićen može zagrijati do 2300 °C. Zbog njegove otpornosti na koroziju, od njegove legure je izrađen prametar (90 % Pt i 10 % Ir). U prirodi se pojavljuje obično kao pratitelj bakarnih i nikalnih ruda, ili kao osmiridij (prirodna legura osmija i iridija) koja sadrži rutenij. Upotrebljava se za legiranje platine i paladija (povećava im tvrdoću).
izoelektrična točka → isoelectric point
Izoelektrična točka (pI ili IEP) je pH otopine ili disperzije pri kojem je neto naboj molekule ili koloidne čestice jednak nuli. U izoelektričnoj točki aminokiseline ne putuju prema elektrodama pod utjecajem električnog polja. Neto naboj (algebarska suma svih nabijenih skupina prisutnih u dipolarnom ionu) aminokiselina, peptida i bjelančevina ovisi o pH vrijednosti otopine. Ispod izoelektrične točke aminokiseline adiraju protone i stvaraju katione a iznad izoelektrične točke se pretvaraju u anione. Primjerice, alanin može imati naboj +1, 0 ili -1 ovisno o pH vrijednosti medija u kojem je otopljen.
Joule-Thomsonov efekt → Joule-Thomson’s effect
Temperatura idealnog plina ne mijenja se kod prigušenja na niži tlak, ali kod prigušenja realnih plinova pojavljuje se, pri višim tlakovima, veća ili manja promjena temperature. Promjena temperature koja se pojavljuje pri ekspanziji realnih plinova u sustavu u koji se ne dovodi energija naziva se Joule-Thomsonov efekt. Ustanovili su da se zraku prigušenom za 1 bar snižava temperatura za 0.25 °C. Taj je neznatni efekt, koji je za većinu tehničkih procesa posve nebitan, iskorišten je za ukapljivanje plinova.
lantanoidi → lanthanides
Lantanoidi ili lantanidi su smješteni unutar 6. periode u 3. podljusci. Imaju nepopunjene niže f-podljuske te se stoga nazivaju unutrašnjim prijelaznim elementima ili f-elementima. U skupinu lantanoida spadaju elementi od rednog broja 58. do rednog broja 71., a često se u lantanoide svrstava i lantan (La). Zbog vrlo sličnih svojstava vrlo teško ih je razdvojiti. Dijelimo ih na cerijevu skupinu ili lake lantanoide: cerij (Ce), praseodimij (Pr), neodimij (Nd), prometij (Pm), samarij (Sm), europij (Eu); i itrijevu skupinu ili teške lantanoide: gadolinij (Gd), terbij (Tb), disprozij (Dy), holmij (Ho), erbij (Er), tulij (Tm), iterbij (Yb) i lutecij (Lu). Lantanoidi se ponekad nazivaju i rijetke zemlje. Osim radioaktivnog prometija ostali lantanoidi i nisu tako rijetki. Cerij je primjerice na 26. mjestu najčešćih elementa u zemljinoj kori i ima ga pet puta više nego olova.
Citiranje ove stranice:
Generalić, Eni. "Skupine periodnog sustava." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav