hematit → haematite
Hematit, Fe2O3, najrašireniji je i najstabilniji željezov oksid te jedna od najzastupljenijih željezovih ruda u prirodi. U laboratorijskim uvjetima hematit se može pripraviti različitim metodama kemijske sinteze. Kontrolom uvjeta sinteze pripravljaju se čestice hematita različitih oblika i veličine. Oblik i veličina kristala hematita određuju njegova fizikalna svojstva, a time i komercijalnu primjenu, npr. kao pigmenata, senzora ili katalizatora.
Željezovi oksidi imaju značajnu tehnološku primjenu. Tradicionalno se upotrebljavaju kao pigmenti, pokrivaju široki raspon boja od žute do crne. Željezovi oksidi kao pigmenti otporni su na kiseline i lužine te visoke temperature. Osim u proizvodnji boja koriste se u gumarskoj i građevinskoj industriji te industriji papira. Budući da su željezovi oksidi netoksični kao pigmenti, koriste se i u prehrambenoj, kozmetičkoj i farmaceutskoj industriji.
Gratzelova sunčeva ćelija → Gratzel solar cell
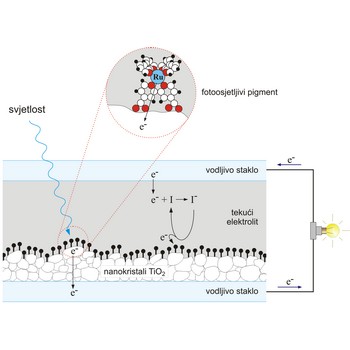
Grätzelova sunčeva ćelija je fotoelektrokemijska ćelija koju je razvio Michael Grätzel sa suradnicima. Oponaša djelomice prirodnu sunčevu ćeliju, koja omogućava biljkama da ostvare fotosintezu. U prirodnoj sunčevoj ćeliji molekule klorofila apsorbiraju svjetlost i to najjače u crvenom i plavom dijelu spektra, dok se zelena svjetlost reflektira. Apsorbirana energija dovoljna je za izbacivanje elektrona iz pobuđenog klorofila. U prijenosu tog naboja, sudjeluju potom druge molekule. U Grätzelovoj ćeliji su, također, za stvaranje naboja apsorpcijom svjetlosti i prijenos tog naboja "zaduženi" različiti dijelovi ćelije.
Na vodljivo staklo nanesen je sloj nanokristala poluvodiča TiO2 čija je površina jako velika. Na TiO2 nanesen je fotoosjetljivi pigment koji čine rutenijevi ioni povezani s organskim molekulama koje jako apsorbiraju vidljivu svjetlost. Fotopobuđeni elektroni prelaze s rutenijevih iona na kristalite TiO2, koji ih odvode daleko od iona-donora. Čitav sustav uronjen je u tekući jodidni elektrolit koji preuzima elektrone s elektrode i prenosi ih na rutenijeve ione kako bi se nastavio proces apsorpcije svjetlosti.
Efikasnost ovih ćelija iznosi oko 10 % i raste u difuznoj svjetlosti, tj. za oblačna vremena.
hafnij → hafnium
Hafnij su 1923. godine otkrili Dirk Costner (Danska) i Georg Karl von Hevesy (Mađarska). Ime je dobio po latinskom nazivu za Kopenhagen - Hafnia. To je srebrno sivi metal visokog sjaja, koji se može kovati. Na izloženoj površini stvara se oksidni film. Otporan na lužine i kiseline (osim HF). Metalni prah se sam zapali i gori na zraku. Spojevi hafnija toliko su slični spojevima cirkonija da ih je skoro nemoguće odvojiti. Pronađen je u svim rudama cirkonija. Kako dobro apsorbira neutrone i kako je otporan na koroziju koristi se za izradu kontrolnih šipki u nuklearnim reaktorima. Upotrebljava se i za legiranje metala, izradu specijalnih stakala, kao i za uklanjanje tragova kisika i dušika iz vakuum cijevi.
polučlanak → half-cell
Polučlanak je dio galvanskog članka u kojem dolazi do oksidacije ili do redukcije elementa u dodiru s vodom ili vodenom otopinom jednog od njegovih spojeva.
poluvalni potencijal → half-wave potential
Poluvalni potencijal (E1/2) je potencijal na kojem je struja polarografskog vala jednaka polovici difuzijske struje (id). Kod reverzibilnih sustava poluvalni potencijal karakterističan je za svaku ionsku vrstu pojedinog elementa (ali ovisi o sastavu otopine) pa se E1/2 može koristiti za kvalitativno određivanje (identifikaciju) elektroaktivnih vrsta.
halogenirani ugljikovodik → halocarbon
Halogenirani ugljikovodici su spojevi koji sadržavaju samo ugljik, jedan ili više halogena, i ponekad vodik, primjerice ugljikov tetraklorid ili tetraklorometan (CCl4), tetrabromometan (CBr4). Niži članovi različitih homolognih nizova koriste se kao sredstva za hlađenje, sredstva za gašenje požara i kao sredstva za pjenjenje poliuretanske pjene. Polimerizacijom halogeniranih ugljikovodika nastaju plastične mase koje karakterizira visoka kemijska otpornost, visoka električna otpornost i dobra toplinska stabilnost.
tvrdoća → hardness
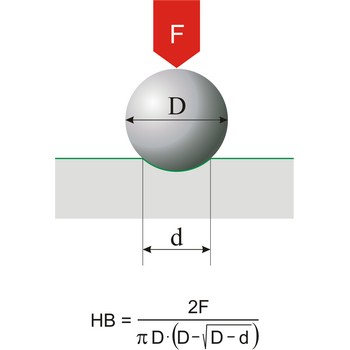
Tvrdoća je otpor materijala prema utiskivanju tijela određene veličine, oblika i poznatog opterećenja. Ova se definicija odnosi na sve tipove skala tvrdoća osim Mohrove skale, koja je zasnovana na otpornosti na grebanje i koristi se uglavnom za minerale. Najčešće korištene skale tvrdoća su: Brinellova (za lijevano željezo), Rockwellova (za lim i toplinski obrađeni čelik) i Knoop (za metale).
teška voda → heavy water
Molekule vode sastavljene su od dva atoma vodika i jednog atoma kisika (H2O). Ako se vodikovi atomi u molekuli vode zamijene s deuterijevim atomima nastat će teška voda (D2O). Deuterij se razlikuje od vodika po tome što ima jedan neutron više u jezgri atoma. Udio teške vode u normalnoj vodi je približno 1:5000 i može se koncentrirati elektrolizom. Teška voda ima i više vrelište (101.4 °C) i više ledište (3.6 °C) od normalne vode. Teška voda je 1.11 puta (20/18=1.11) teža od obične vode.
poluacetal → hemiacetal
Poluacetali ili hemiacetali organski su spojevi opće formule R2C(OH)OR’ (R’ ≠ H) dobiveni adicijom molekule alkohola na karbonilnu skupinu aldehida ili ketona. Poluacetali su općenito nestabilni spojevi a stabilnija konfiguracija nastaje kada intramolekularnom ciklizacijom nastane peteročlani furanozni ili šesteročlani piranozni prsten. Prvotno se izraz poluacetali (hemiacetali) odnosio samo na poluacetale izvedene iz aldehida (jedan R = H) ali je danas proširen i na one izvedene iz ketona (poluketale) (oba R ≠ H).
poluketal → hemiketal
Poluketali ili hemiketali organski su spojevi opće formule R2C(OH)OR (R ≠ H) dobiveni adicijom molekule alkohola na karbonilnu skupinu ketona. Ako su keto i hidroksilna skupina u sastavu istog spoja, intramolekulskom ciklizacijom nastaje ciklički poluketal. Ovaj naziv bio je odbačen, ali je vraćen u upotrebu kao podklasa poluacetala.
Citiranje ove stranice:
Generalić, Eni. "S visc chemistry." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav