superfluidni helij → superfluid helium
Superfluidnost helija otkrio je 1938. sovjetski fizičar Pyotr Leonidovich Kapitsa. Helij-4 pokazuje superfluidna svojstva kada se ohladi ispod 2.18 K (-270.97 °C), tzv. lamda-točka (λ). Pri ovim temperaturama tekući helij (helij II) je fluid s ekstremno niskom viskoznošću i ekstremno visokom specifičnom provodnošću topline. Toplinska vodljivost helija II je oko tri milijuna puta veća od helija I (tekući helij iznad 2.18 K). Ako se helij II stavi u neku posudu, tekućina će se penjati po unutrašnjoj strani a spuštati po vanjskoj strani posude.
superoksid → superoxide
Superoksidi binarni su spojevi koji sadrže kisik sa stupnjem oksidacije -½. Superoksidni ion, O2-, ima nespareni elektronski par i vremenom se spontano disproporcionira u peroksid. Teži alkalijski elementi (K, Rb, Cs) stvaraju superokside direktnim spaljivanjem na zraku (KO2, RbO2, CsO2). To su žuto do narančasto obojeni paramagnetični spojevi. Superoksidi su jaki oksidansi koji burno hidroliziraju dajući peroksid i elementarni kisik.
suzavac → tear gas
Suzavci su zajedničko ime za tvari koje, u niskim koncentracijama, uzrokuju bol u očima, suzenje i nemogućnost držanja otvorenih očiju. Suzavci se koriste uglavnom u vojnim vježbama i policijskim akcijama, ali su također korišteni i kao sredstva za ratovanje. Iritirajući plinovi su bili korišteni i u antičkim ratovima, ali se tek nakon Drugog svjetskog rata sustavnije istražuju. Tri najvažnija predstavnika suzavaca jesu: kloroacetofenon (CN), orto-klorobenziliden-malononitril (CS) i dibenz(b,f)-1,4-oksazepine (CR). Učinkoviti su a rizičnost po zdravlje je niska.
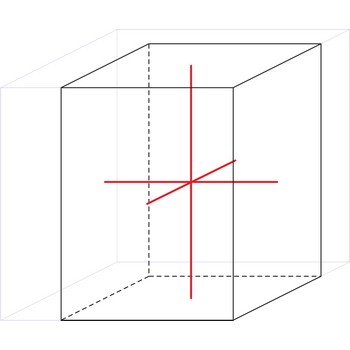
tetragonski kristalni sustav → tetragonal crystal system
U tetragonskom kristalnom sustavu sve tri kristalografske osi okomite su. Dvije vodoravne osi su jednake duljine a treća je duža ili kraća od njih.
a = b ≠ c
α = β = γ = 90°
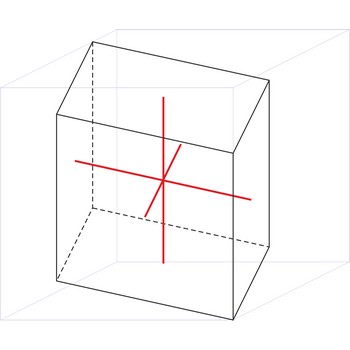
triklinski kristalni sustav → triclinic crystal system
U triklinskom kristalnom sustavu sve tri kristalografske osi različite su duljine. Ni jedna od triju osi nije okomita na bilo koju drugu os.
a ≠ b ≠ c
α ≠ β ≠ γ ≠ 90°
kiselina → acid
Kiseline su vrsta spojeva koji sadrže vodik i disocijacijom u vodi daju pozitivne vodikove ione pri čemu je rezultirajući pH manji od 7. Reakcija za kiselinu HA može se napisati kao
Ustvari, vodikov je ion (proton) solvatiziran pa reakcija disocijacije kiseline izgleda ovako:
Ova definicija kiselina dolazi iz Arrheniusove teorije. Kiseline su tvari čije vodene otopine imaju kiseli okus, korozivne su i mijenjaju boju lakmus-papira u crvenu.
Kiseline možemo podijeliti na jake, koje potpuno disociraju u vodi (npr. sulfatna i kloridna kiselina), i slabe kiseline, koje su samo djelomično disocirane (npr. octena i sumporvodična kiselina). Jakost kiseline ovisi o stupnju disocijacije i izražava se konstantom disocijacije kiseline.
Arrheniusovu definiciju kiselina i baza proširili su J. M. Lowry i J. N. Brønsted 1923. Njihova teorija definira kiselinu kao tvar koja daje proton (proton donor), a bazu kao tvar koja je sposobna primiti proton (proton akceptor). Da bi se neka jedinka ponašala kao kiselina, mora biti prisutan proton akceptor (baza). Lowry-Brønstedova teorija kaže da kad neka kiselina dade proton, nastane konjugirana baza koja može primiti proton.
Prema Lowry-Brønstedovoj predodžbi, kad neka kiselina dade proton, uvijek nastane konjugirana baza koja može primiti proton.
Slično, od svake baze kao rezultat primitka protona nastane konjugirana kiselina.
Primjerice, acetatni ion je konjugirana baza octene kiseline, a amonijev ion je konjugirana kiselina amonijaka.
Što je kiselina konjugiranog kiselo/baznog para slabija, njezina konjugirana baza postaje jača, i obrnuto.
Najopćenitiju definiciju kiselina dao je G. N. Lewis koji sve kemijske vrste koje mogu primiti elektronski par naziva kiselinama. Ova definicija uključuje sve "tradicionalne" kiselo-bazne reakcije, ali sadrži i reakcije koje ne uključuju ione, primjerice
u kojoj je NH3 baza (donor elektronskog para) a BCl3 kiselina (akceptor elektronskog para).
energija aktivacije → activation energy
Energija aktivacije ili energija aktiviranja reakcije (Ea) energija je koju je potrebno dovesti molekulama da međusobno reagiraju. Da bi molekule kemijski reagirale, moraju se sudariti, ali međusobno mogu reagirati samo one molekule koje imaju veću energiju od energije aktiviranja. U kemijskoj kinetici energija aktivacije je visina potencijalne barijere koja odvaja produkte od reaktanata. Što je energija aktivacije veća, to manji broj molekula može prijeći vrh energetske barijere i reakcija je sporija.
alkalijski metal → alkali metal
Alkalijski metali su elementi 1. skupine periodnog sustava: litij (Li), natrij (Na), kalij (K), rubidij (Rb), cezij (Cs) i francij (Fr).. Imaju malu gustoću i toliko su mekani da se mogu rezati nožem. Svi su metali i burno reagiraju s vodom razvijajući toplinu i vodik. Reaktivnost im raste porastom atomske mase. Jednovalentni su i gotovo sve njihove soli lako su topljive u vodi. Grade jake baze koje potpuno disociraju na ione. Pridjev alkalni daje se svim tvarima s jako izraženim lužnatim osobinama.
zemnoalkalijski metal → alkaline earth metal
Zemnoalkalijski metali su elementi 2. skupine periodnog sustava: berilij (Be), magnezij (Mg), kalcij (Ca), stroncij (Sr), barij (Ba) i radij (Ra). U vanjskoj ljusci imaju dva elektrona i uglavnom se pojavljuju u oksidacijskom stanju +2. Svi su metali male gustoće i vrlo reaktivni iako manje od alkalijskih metala. Reaktivnost im raste porastom atomske mase. Berilijev hidroksid je praktično netopljiv u vodi a topljivost ostalih hidroksida raste s porastom atomske mase metala. Nazvani su zemnoalkalijskim jer vodene otopine njihovih oksida ("zemlje") imaju lužnatu (alkalnu) reakciju.
Citiranje ove stranice:
Generalić, Eni. "Sửa báo cáo khoản vay nước ngoài." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav