redoks potencijal → redox potential
Elektrodni ili redoks potencijal je potencijal reverzibilne oksidacijsko-redukcijske elektrode mjeren s obzirom na referentnu elektrodu te korigiran s obzirom na standardnu vodikovu elektrodu u danom elektrolitu.
redoks-reakcija → redox reaction
Redoks-reakcije su oksidacijsko-redukcijske reakcije u kojoj se prenosi jedan ili više elektrona. Kada atom, ion ili molekula izgubi jedan ili više elektrona on se oksidirao. Kada atom, ion ili molekula primi jedan ili više elektrona on se reducirao.
redoks-titracija → redox titration
Redoks-titracija (oksidacijsko-redukcijska titracija) je titracija bazirana na redoks-reakciji. Npr. željezo u vodi se može odrediti tako da se otopljeno željezo prevede u Fe2+ i zatim titrira otopinom kalijeva permanganata (KMnO4), koji je jako oksidacijsko sredstvo.
elektrodni potencijal → electrode potential
Elektrodni potencijal je potencijal elektrokemijske ćelije u kojoj je ispitivana elektroda spojena kao katoda a standardna vodikova elektroda (E = 0.000 V) kao anoda. Na katodi se uvijek događa redukcija a na anodi oksidacija.
Elektrodni potencijal je po definiciji redukcijski potencijal. Prema IUPAC-ovu dogovoru, izraz elektrodni potencijal namijenjen je isključivo za polureakcije napisane kao redukcije. Predznak elektrodnog potencijala određen je predznakom dotičnog polučlanka spojenog sa standardnom vodikovom elektrodom. Pozitivni predznak upućuje na to da je reakcija spontana u odnosu na standardnu vodikovu elektrodu, tj. da se polučlanak spontano ponaša kao katoda.
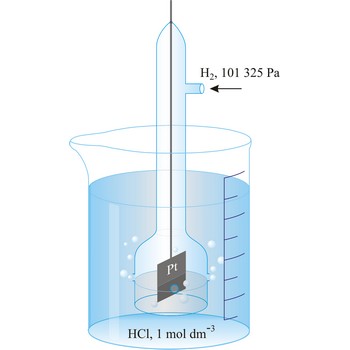
Članak za mjerenje elektrodnog potencijala sastoji se od standardne vodikove elektrode (dogovorno se piše lijevo)
i elektrode ispitivanog redoks-sustava (dogovorno se piše desno)
i može se shematski napisati kao
Elektromotorna sila (e.m.f.) ispitivanog redoks sustava jednaka je
Dogovorno je uzeto da je pri p(H2) = 101325 Pa i a(H+) = 1.00, potencijal vodikove elektrode jednak je 0.000 V pri svim temperaturama. Posljedica je takve definicije da se ukupni potencijal svakoga galvanskog članka koji sadrži standardnu vodikovu elektrodu pripisuje drugoj elektrodi
indikator → indicator
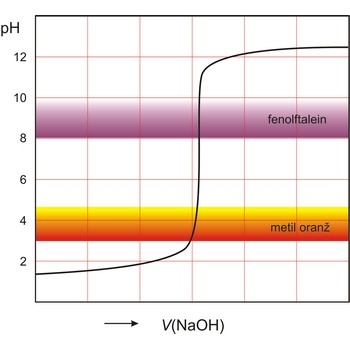
Indikator je tvar koja u otopini daje vidljivu promjenu (obično promjenu boje) u prisutnosti kemijske vrste. Koriste se za označavanje završetka kemijske reakcije. Indikatori se dijele prema vrstama kemijskih reakcija u kojima se primjenjuju (kiselo-lužnate, redoks, taložne, kompleksirajuće i adsorpcijske).
Kiselo-bazni indikatori su spojevi, kao npr. fenolftalein i metil oranž, koji reverzibilno mijenjaju boju ovisno o tome je li otopina kisela ili bazna. Oksidacijsko-redukcijski indikatori su tvari koje reverzibilno mijenjaju boju između svog oksidiranog i reduciranog oblika.
oksidacija → oxidation
Kemijske spojeve s kisikom zovemo oksidima, a samu kemijsku reakciju spajanja s kisikom, oksidacijom. Oksidacija nije samo spajanje s kisikom već se kod oksidacije oksidacijski broj atoma povisuje, a kod redukcije snizuje. Svaki proces oksidacije mora pratiti proces redukcije. Zato takve reakcije skraćeno nazivamo redoks-reakcijama.
galvanski članak → galvanic celll
Galvanski članak (naponski članak, Voltin članak) jest elektrokemijski članak u kojem se kemijska energija spontano pretvara u električnu. Galvanski članak sastoji se od dva polučlanka, a svaki polučlanak od elektrode uronjene u elektrolit. Elektrolit može biti zajednički za obje elektrode ili različit za svaku elektrodu. Dva elektrolita odvajamo polupropusnom membranom ili ih spajamo elektrolitskim mostom. Ako se elektrode povežu nekim vodičem, elektroni putuju kroz vodič od negativnog pola prema pozitivnom polu.
Danielov članak je primjer galvanskog članka. Sastoji se od bakrene i cinkove elektrode, a kao elektrolit služe otopine bakrova(II) sulfata i cinkova sulfata odijeljene polupropusnom membranom. Kada se elektrode spoje električnim vodičem kroz strujni krug će proteći električna struja. Na negativnom polu (cinkovoj elektrodi) zbiva se proces oksidacije A na pozitivnom polu (bakrenoj elektrodi) zbiva se proces redukcije.
Elektromotornu silu galvanskog članka možemo izračunati iz razlike redoks potencijala tvari koja se reducirala (bakra) i tvari koja se oksidirala (cinka).
Galvanski članak može se shematski prikazati upotrebom okomite crte. Uobičajeno je da se oksidirana vrsta piše s lijeve strane.
Ime je dobila u čast talijanskog znanstvenika i liječnika Luigia Galvania (1737.-1798.).
Nernstova jednadžba za elektrodni potencijal → Nernst’s electrode potential equation
Za opću reakciju nekog redoks-sustava
ovisnost elektrodnog potencijala redoks sustava o aktivitetu oksidiranog i reduciranog oblika u otopini daje nam Nernstova jednadžba za elektrodni potencijal:
gdje je E = elektrodni potencijal redoks-sustava
E° = standardni elektrodni potencijal redoks-sustava
R = univerzalna plinska konstanta
T = termodinamička temperatura
F = Faradayeva konstanta
z = broj elektrona koji se izmjenjuju u redoks-reakciji
aO = aktivitet oksidiranog oblika
aR = aktivitet reduciranog oblika
n = stehiometrijski koeficijent oksidiranog oblika
m = stehiometrijski koeficijent reduciranog oblika
potenciometrijska titracija → potentiometric titration
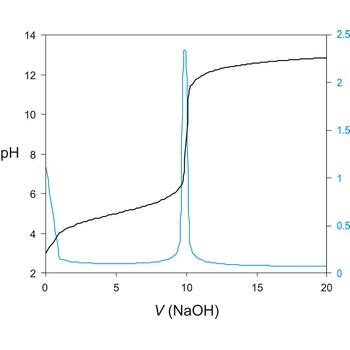
Potenciometrijska titracija je volumetrijska metoda kojom se mjeri potencijal između dvije elektrode (referentne i indikatorske elektrode) kao funkcija dodanog volumena reagensa. Temeljni princip potenciometrijske titracije je određivanje nepoznate koncentracije ispitivane otopine titracijom s nekom standardnom otopinom pri čemu skokovita (nagla) promjena potencijala indikatorske elektrode ukazuje i određuje završnu točku titracije.
Instrumentalno određivanje završne točke ima niz prednosti u odnosu na korištenje indikatora. Vizualno određivanje završne točke opterećeno je subjektivnim faktorima, a ne može se koristiti u mutnim i obojenim otopinama. Potenciometrijske metode određivanja završne točke mogu se primijeniti, ne samo za kiselo-bazne titracije već i kod taložnih, redoks i drugih titracija.
Titracijska krivulja ima karakterističan sigmoidalni oblik. Dio krivulje s maksimalnom promjenom potencijala je ekvivalentna točka titracije. Točku ekvivalencije možemo točnije odrediti iz diferencijalne krivulje ΔE/ΔV gdje maksimum krivulje određuje točku ekvivalencije.
Citiranje ove stranice:
Generalić, Eni. "Redoks." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav