dipolni moment → dipole moment
Električni dipolni moment (μ) jednak je umnošku naboja i razmaka između težišta naboja. SI jedinica za dipolni moment jest kulon metar (C m) dok se u literaturi često može naći i jedinica debye (D). U diatomnoj molekuli, kao što je HCl, dipolni moment je mjera polarnosti veze. U poliatomnim molekulama dipolni moment je vektorska suma dipolnih momenata svake pojedine veze u molekuli. U simetričnih molekula, kao što je tetrafluorometan (CF4) ne postoji ukupni dipolni moment iako su pojedinačne C-F veze polarne. Mjerenjem dielektrične konstante može se odrediti tzv. dipolni moment molekula pojedinih tvari koji je to veći što su veći naboji polova i što su polovi udaljeniji.
elektronegativnost → electronegativity
Elektronegativnost je snaga kojom atom pojedinog elementa privlači elektrone. Primjerice, u klorovodiku atom klora je mnogo negativniji od atoma vodika i molekula je polarna, s negativnim nabojem na atomu klora. Elementi s velikom elektronegativnošću lako tvore negativne ione.
L. Pauling je, određivanjem energije kemijske veze, dao svoju skalu relativnih elektronegativnosti. Na toj skali fluor ima najveću elektronegativnost (4), a francij najmanju (0.7).
Što atom ima veću elektronegativnost, to jače privlači elektrone, a što je veća razlika u elektronegativnosti između elemenata, to je veći stupanj ionskog karaktera veze između njihovih atoma. Kad je razlika u relativnoj elektronegativnosti 1.9, udio je ionskog karaktera veze oko 50 %.
Fajansova pravila → Fajans’ rules
Fajansova pravila, koja je formulirao američki kemičar poljskih korijena Kazimierz Fajans (1887-1975), pomažu u procjeni udjela ionske u kovalentnoj vezi kao posljedice polarizacije iona. Kovalentni karakter je to vjerovatniji:
1. ako je naboj iona velik
2. ako je pozitivni ion mali, a negativni velik
3. ako pozitivni ion nema u vanjskoj ljusci konfiguraciju plemenitog plina
nemetal → non-metal
Nemetali su elementi koji ne pokazuju metalna svojstva (slabi su vodiči topline i električne struje, ne daju se kovati itd.). Njihove se molekule uglavnom sastoje od kovalentno vezanih atoma osim kod idealnih plinova koji su monoatomni.
Smješteni su skroz desno u periodnom sustavu. Oksidi nemetala otapanjem u vodi daju kiseline. Nemetali imaju skoro popunjenu vanjsku ljusku s elektronima i lako se spajaju jedan s drugim ili s metalima. Kod mnogih elemenata ove grupe susrećemo alotropiju.
rezonancija → resonance
Rezonancija je način opisivanja i procjenjivanja kovalentne veze kod molekula ili iona koji se ne mogu adekvatno opisati jednom Kekuleovom strukturom. Određene kanonske strukture se mogu nacrtati kako bi se što bolje objasnila delokalizacija elektrona i nesklad u gustoći elektrona. Strukture rezonantog hibrida nisu različite vrste molekula, već jedna jedina molekula hibridne strukture.
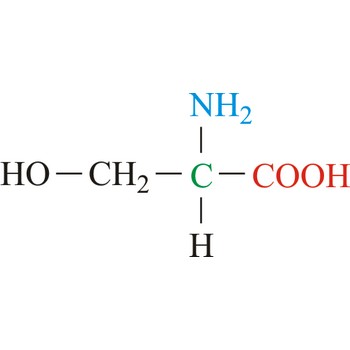
serin → serine
Serin je neutralna aminokiselina s polarnim pobočnim lancem. To je jedna od dvije aminokiseline koje sadrže hidroksilnu skupinu u pobočnom lancu (druga je treonin). Obje su jako hidrofilne zbog mogućnosti stvaranja vodikove veze. U mnogim enzimima na aktivnim mjestima nalazi se serin čija je funkcija da posluži kao nukleofilni centar. Serin je mjesto na kojem dolazi do fosforilacije i glikolizacije što je važno za regulaciju enzima i staničnu signalizaciju. On je neesencijalna aminokiselina koja se sintetizira u ljudskom tijelu od drugih metabolita i glicina.
- Kratice: Ser, S
- IUPAC ime: 2-amino-3-hidroksipropanska kiselina
- Molekularna formula: C3H7NO3
- Molekularna masa: 105.09 g/mol
strukturna formula → structural formula
Strukturna formula je dvodimenzijski prikaz rasporeda atoma u molekuli. Atomi su prikazani simbolima, a kovalentne veze linijama. Simbol za ugljik često se ne prikazuje.
reakcije adicije → addition reactions
Reakcije adicije obično se pojavljuju kod nezasićenih spojeva i uključuju adiciju jedne molekule (reaktanta) preko nezasićene veze (npr. dvostruka ili trostruka veza) na drugu molekule (supstrata) čime se dobije jedinstven produkt koji je formiran kombinacijom obadviju reagirajućih molekula.
Npr. adicija broma preko dvostruke veze etena u reakciji adicije da nastane dibrometan.
Citiranje ove stranice:
Generalić, Eni. "Polarna kovalentna veza." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav