hidrofobne interakcije → hydrophobic interaction
Hidrofobne interakcije su tendencija ugljikovodika (ili ugljikovodicima sličnim skupinama u otopinama) da stvaraju intermolekularne nakupine u vodenoj sredini, i analogne intramolekularne interakcije. Ime je nastalo od pojave "mržnje" između vode i ugljikovodika. Ne preporučuje se upotreba zbunjujućeg alternativnog izraza hidrofobna veza.
ionski izmjenjivač → ion exchanger
Ionski izmjenjivači su visokopolimerni spojevi koji imaju svojstvo da vežu ione iz otopine, a pri tome oslobađaju ekvivalentnu količinu istoimeno nabijenih iona. Ion izmjenjivačke smole sadrže različite kopolimere čvrsto vezane u trodimenzionalanu strukturu na koju su pričvršćene ionske skupine. Ovisno o strukturi imamo kationske i anionske izmjenjivače. Upotrebljavaju se za prečišćavanje različitih otopina, lijekova, demineraliziranje vode i dr.
Kjeldahlov postupak → Kjeldahl’s method
Kjeldahlov postupak je analitička metoda za određivanje dušika u bjelančevinama i nekim drugim organskim spojevima. Postupak je razvio danski kemičar Johan Kjeldahl (1849.-1900.).
U otopinu s uzorkom doda se malo bezvodnog kalijeva sulfata i koncentrirane sulfatne kiseline. Smjesa se zagrijava, često uz prisutnost katalizatora (npr. bakrova sulfata). Dušik se veže u amonijev sulfat iz kojeg se kuhanjem s natrijevim hidroksidom oslobađa amonijak. Oslobođeni amonijak se odvoji destilacijom i skuplja u točno određenom volumenu standardne kiseline. Sadržaj dušika odredi se retitracijom viška kiseline.
- Kjeldahlova tikvica za razgradnju (500 ml – makro ili 100 ml - mikro)
- lijevak za alkalnu otopinu
- Wagnerova cijev (hvatač kapi)
- hladilo
- apsorpcijska tikvica s poznatim volumenom otopine standardne kiseline
laktoza → lactose
Laktoza (mliječni šećer) je didsaharid koji se sastoji od jedne molekule glukoze povezane s galaktozom β(1→4)-glikozidnom vezom. Laktoza je beta acetal. Javlja se samo u mlijeku sisavaca gdje je ima o 4 % do 7 %. Netolerancija na laktozu česta je bolest koja rezultira proljevom, bolovima u trbuhu i nadutošću a uzrokovana je smanjenom aktivnošću enzima laktaze.
Laktoza je, kao i celebioza i maltoza, reducirajući šećer. Svi reducirajući šećeri pokazuju mutarotaciju kada se otope u vodi. Ravnotežna smjesa pri 20 °C sastoji se od 62.7 % β-laktoze (β-D-galaktopiranozil-(1→4)-β-D-glukopiranoze) i 37.3 % α-laktoze (β-D-galaktopiranozil-(1→4)-α-D-glukopiranoze).
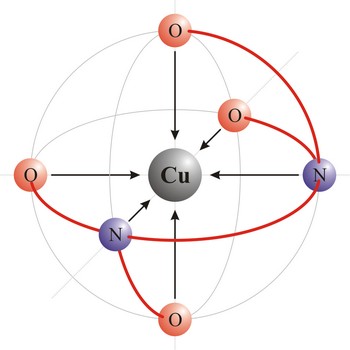
ligand → ligand
Ligandi su molekule ili ioni koji se s centralnim metalnim ionom vezuju u kompleks. Ligandi mogu biti ioni ili molekule koji imaju slobodne elektronske parove. Takvi ioni jesu: fluorid (F-), klorid (Cl-), bromid (Br-), jodid (I-), sulfid (S2-), cijanid (CN-), tiocijanat (NCS-), hidroksid (OH-), peroksid (O22-), nitrozil (NO+), nitrit (NO2-), amid (NH2-), karbonat (CO32-), tiosulfat (S2O32-). Molekule su: amonijak (NH3), voda (H2O), dušikov monoksid (NO), ugljikov monoksid (CO). Ligandi se klasificiraju prema broju veza koje mogu ostvariti s centralnim atomom. Ligandi s jednim potencijalnim donorom elektrona su monodentatni ligandi s više polidentatni ligandi. Ligandi s više donorskih atoma koji se mogu vezati s centralnim atomom samo preko jednog od njih nazivaju se ambidentatni ligandi. Kelatni ligandi su polidentatni ligandi koji sasvim obuhvate centralni atom poput škara morskog raka.
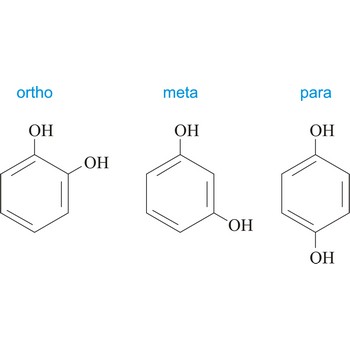
meta položaj → meta position
Meta položaj u organskoj kemiji onaj je položaj kada su na benzenovom prstenu vezane dvije skupine u položaju 1 i 3. Upotrebljava se kratica m-, npr. m-hidrokinon je 1,3-dihydroxybenzene.
metionin → methionine
Metionin je neutralna aminokiselina s polarnim pobočnim lancem. On je jedna od dvije aminokiseline koje u svojoj strukturi imaju sumpor (druga je cistein). Metionin je hidrofobna aminokiselina i obično se može naći u unutrašnjosti bjelančevine. Može stupiti u interakciju s aromatskim prstenima aromatskih aminokiselina i važan je nositelj metilenske skupine za metiliranje. Metionin je esencijalna aminokiselina koju ljudski organizam ne može sintetizirati te se mora unijeti preko hrane.
- Kratice: Met, M
- IUPAC ime: 2-amino-4-metilsulfanilbutanska kiselina
- Molekularna formula: C5H11NO2S
- Molekularna masa: 149.21 g/mol
Newmanova projekcija → Newman’s projection
Newmanova projekcija je slika koja se dobije promatranjem modela molekule uzduž C-C veze.
dušik → nitrogen
Dušik je 1772. godine otkrio Daniel Rutherford (Škotska). Ime mu dolazi od grčkog naziva za salitru - nitron i riječi genesis što znači stvarati. Lavoisier mu je dao ime azote od grčke riječi azotikos što znači onaj koji ne podržava život. To je plin bez boje i mirisa koji je skoro inertan na sobnoj temperaturi. Dio je mnogih organskih i anorganskih spojeva. Ne gori niti podržava gorenje. Nalazi se slobodan u zraku (78 %) kao i vezan u spojevima salitri (KNO3), čilskoj salitri (NaNO3), amonijaku (NH3). Dobiva se destilacijom tekućeg zraka. Upotrebljava se kao sirovina za dobivanje dušične kiseline, amonijaka, umjetnih gnojiva, eksploziva.
Citiranje ove stranice:
Generalić, Eni. "Polarna kovalentna veza." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav