Gibbsova slobodna energija → Gibbs free energy
Gibbsova slobodna energija (G) jest energija oslobođena ili apsorbirana u reverzibilnom procesu pri konstantnoj temperaturi i tlaku. Definirana je jednadžbom
gdje je H entalpija, S entropija a T termodinamička temperatura. Naziva se još i Gibbsova energija ili samo slobodna energija.
Promjena Gibbsove slobodne energije, ΔG, određuje smjer kemijske reakcije. Ako je ΔG neke reakcije negativan, reakcija će se spontano odvijati dok se ne uspostavi ravnotežno stanje. Kada je postignuto ravnotežno stanje, onda je ΔG = 0.
zlato → gold
Zlato je poznato od davnih vremena (~3000. godine prije Krista). Simbol elementa dolazi od latinskog naziva za zlato - aurum. To je sjajni, žuti metal. Mekan, kovak i savitljiv te se može izvući u listiće debele samo 10-5 mm. Ne zraku je stabilno i ne reagira s kisikom ni na kojoj temperaturi. Ne otapa se u kiselinama ni lužinama. Otapa se jedino u zlatotopci (HNO3:HCl=1:3) i u cijanidnim otopinama koje sadrže kisik, zbog stvaranja kompleksa s kloridom odnosno cijanidom. Zlato je rijedak element i ima ga deset puta manje od srebra. U prirodi se obično nalazi u elementarnom stanju u kremenim žilama ili pijesku rijeka. Upotrebljava se za izradu nakita, novca, zubnih proteza kao i za elektroničke krugove i kontakte.
halogeni elementi → halogens
U 17. skupinu periodnog sustava spadaju fluor (F), klor (Cl), brom (Br), jod (I) i astat (At). Zajedničkim imenom nazivaju se halogenima (oni koji tvore soli) zbog toga što izravno s metalima daju soli. U vanjskoj ljusci imaju 7 elektrona pa su izrazito elektronegativni. Reagiraju sa skoro svim metalima i mnogim nemetalima. Reaktivnost im opada porastom atomske mase. Halogeni imaju jak neugodan miris i gore sjajnim plamenom.
U elementarnom stanju halogeni elementi prave dvoatomne molekule. Kako raste volumen atoma, rastu i Van der Waalsove privlačne sile. Tako su pri sobnoj temperaturi fluor i klor plinovi, brom tekućina, a jod i astat čvrste tvari.
vodik → hydrogen
Vodik je 1766. godine otkrio Sir Henry Cavendish (Engleska). Ime mu je dao Lavoisie od grčkih riječi hydro što znači voda i genes što znači tvoriti. To je plin bez boje i mirisa, netopljiv u vodi. Lako difundira kroz sve materijale. Zapaljiv je i pravi eksplozivne smjese u zraku. Zapaljen na zraku gori svijetlim vrućim plamenom dajući vodenu paru. Na povišenoj temperaturi lako se spaja s kisikom, sumporom i halogenim elementima. Procjenjuje se da 90 % svih atoma, odnosno skoro 3/4 mase svemira, otpada na vodik. Sve zvijezde, pa i Sunce, sastavljene su uglavnom od vodika (w>90 %). Vodik se u prirodi rijetko nalazi u elementarnom stanju, samo u višim slojevima atmosfere ili u vulkanskim plinovima. Uglavnom je vezan u spojevima od kojih su najrašireniji voda (H2O), amonijak (NH3) i razni organski spojevi. Čisti vodik se najčešće dobiva elektrolizom vode. Laboratorijski se dobiva reakcijom sulfatne kiseline i elementarnog cinka. Industrijski se dobiva prevođenjem vodene pare preko užarenog koksa. Upotrebljava se za sintezu amonijaka, hidriranje ugljena i ulja, proizvodnju kloridne kiseline i kao redukcijsko sredstvo.
sublimacija → sublimation
Sublimacija je prijelaz tvari iz čvrstog izravno u plinovito stanje bez prethodnog prijelaza u tekućinu. Suhi led (smrznuti CO2) na sobnoj temperaturi sublimira.
prezasićena otopina → supersaturated solution
Prezasićena otopina je ona otopina koja sadrži veću količinu otopljene tvari nego što to odgovara topljivosti te tvari na danoj temperaturi. To je nestabilno stanje i već protresanjem otopine može doći do izlučivanja viška otopljene soli.
Hessov zakon → Hesse’s law
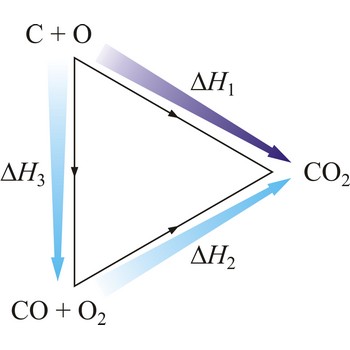
Zakonitost termokemijskih pojava otkrio je 1840. ruski kemičar švicarskog porijekla Germain Henri Hess (1802.-1850.). Njegov zakon glasi: Reakcijska toplina neke kemijske promjene ne ovisi o putu kojim reakciju vodimo, već samo o početnom i konačnom stanju sustava. Hessov zakon poznat je i kao zakon o stalnosti zbroja toplina reakcije.
Na primjer, eksperimentalno je određena entalpija oksidacije grafita u ugljikov dioksid i ugljikova monoksida u ugljikov dioksid. Zbog ravnoteže
nije moguće odrediti entalpiju oksidacije grafita u ugljikov monoksid. Međutim, reakcijska toplina te reakcije može se izračunati primjenom Hessovog zakona.
| C(s) + O2(g) →← CO2(g) | ΔrH1 = -393 kJ mol-1 |
| CO(g) + 1/2O2(g) →← CO2(g) | ΔrH2 = -283 kJ mol-1 |
| C(s) + 1/2O2(g) →← CO(g) | ΔrH3 = -110 kJ mol-1 |
hidrosfera → hydrosphere
Hidrosfera (iz grčkog imena za vodenu kuglu) je diskontinuirani vodeni omotač koji obuhvaća svu vodu na, ispod i iznad Zemljine površine bez obzira u kakvom se agregatnom stanju nalazi. To uključuje sve tekuće i smrznute površinske vode, podzemne vode zadržane u tlu i stijenama te vodenu paru u atmosferi. Voda neprestano kruži između ovih vodnih retencija (rezervoara) u tzv. hidrološkom ciklusu koji energiju dobiva iz Sunca.
| Vodne zalihe | V / 106 km3 | w / % |
|---|---|---|
| oceani | 1 370.0 | 97.25 |
| ledene kape i glečeri | 29.0 | 2.05 |
| podzemne vode | 9.5 | 0.68 |
| jezera i rijeke | 0.127 | 0.01 |
| vlaga u tlu | 0.065 | 0.005 |
| atmosfera (kao tekući ekvivalent vodene pare) | 0.013 | 0.001 |
| biosfera | 0.0006 | 0.00004 |
| UKUPNO | 1 408.7 | 100 |
indij → indium
Indij su 1863. godine otkrili Ferdinand Reich i Hieronymus Theodor Richter (Njemačka). Ime je dobio po karakterističnoj indigoplavoj liniji u vidljivom dijelu atomskog spektra. To je srebrno bijeli metal, mekan poput voska koji je stabilan na zraku i u vodi. Topljiv je u kiselinama uz razvijanje vodika. Spojevi indija, naročito ako su u koloidnom stanju, su toksični ako se progutaju. Indij je rijedak metal koji se nigdje ne javlja u većim količinama. Dobiva se kao nusproizvod prerade sulfidnih ruda cinka, željeza i bakra. Upotrebljava se u elektronici, legura In-Cd-Ag se koristi za izradu kontrolnih šipki u nuklearnom reaktoru. Spojevi indija upotrebljavaju se za proizvodnju infracrvenih detektora.
Citiranje ove stranice:
Generalić, Eni. "Nascentno stanje." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav