romboedarska rešetka → rhombohedral lattice
Romboedarska ili trigonska rešetka ima po jedan čvor kristalne rešetke u svakom uglu jedinične ćelije. Kristalografski vektori jedinične ćelije su a = b = c a kutovi među njima α=β=γ≠90°.
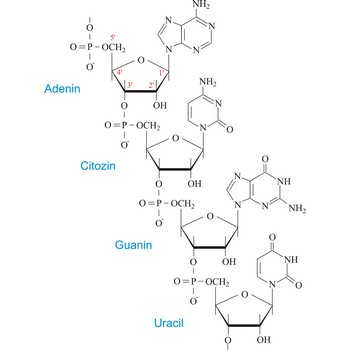
ribonukleinska kiselina → ribonucleic acid
Ribonukleinska kiselina (RNK ili RNA) je dugačka lančasta molekula koja služi kao posrednik između DNK i njihovog konačnog produkta, bjelančevina. Neki virusi koriste RNK molekule za prijenos genetskih informacija umjesto DNK.
Ribonukleinska kiselina i dezoksiribonukleinska kiselina kemijski su vrlo slične molekule. U RNK je pirimidinska baza timin zamijenjena uracilom, a šećer je riboza umjesto dezoksiriboze. RNK su sastavljene od dušičnih purinskih baza adenina i gvanina, dušičnih pirimidinskih baza citozina i uracila, šećera riboze i fosforne kiseline. Za razliku od DNK RNK je jednolančana molekula.
Imamo tri glavna tipa obzirom na funkciju RNK u stanici: (1) ribosomske RNK koje izgrađuju ribosome u citoplazmi; (2) glasničke (messengers), dugačke, nitaste, mjestimično poput čvorova savijene molekule velike molekularne mase, sastavljene od dugih nizova ribonukleotida; služe kao prijenos biološke uloge DNK iz jezgre u citoplazmu; (3) transportne (transfer) RNK relativno malih molekula sastavljenih od svega 75-90 nukleotida, molekularne mase oko 30 000.; prenose aminokiseline na ribosome, gdje se obavlja sinteza bjelančevina, koji su strukturne bjelančevine, enzimi ili hormoni odgovorni za osnovnu strukturu i funkciju živih organizama.
zeta potencijal → zeta potential
Zeta potencijal (ζ) jest potencijal preko granice faza svih čvrstih tijela i tekućina. Osobitose odnosi na potencijal difuznog sloja iona koji okružuju nabijenu koloidnu česticu, i koji je velikim dijelom odgovoran za stabilnost koloida. Također se naziva i elektrokinetički potencijal.
Zimmermann-Reinhardtov reagens → Zimmermann-Reinhardt’s reagent
Zimmermann-Reinhardtov reagens jest smjesa manganova(II) sulfata, sumporne i fosforne kiseline. Služi za sprječavanje oksidacije kloridnog iona pri titraciji željezova(II) iona otopinom permanganata.
rubidij → rubidium
Rubidij su 1861. godine otkrili Robert Bunsen i Gustav Kirchhoff (Njemačka). Ime je dobio prema latinskoj riječi rubidus što znači tamnocrven. To je veoma mekani metal sa sjajnom, srebrno bijelom površinom kada je svježa. Brzo potamni na zraku. Burno reagira s vodom a na zraku izgara do superoksida (RbO2). Obično se nalazi uz ostale alkalijske metale pa se dobiva kao nusprodukt pri proizvodnji kalija iz karnalita. Koristi se za proizvodnju fotoelektričnih ćelija.
rutenij → ruthenium
Rutenij je 1844. godine otkrio Karl Karlovich Klaus (Rusija). Ime je dobio od latinskog naziva za Rusiju - Rutenia. To je sjajni i tvrdi srebrni metal koji zajedno s rodijem i paladijem čini skupinu lakih platinskih metala. Stabilan je na zraku, u vodi i kiselinama ali reagira s talinama alkalija. Rutenijev(VIII) oksid je lako hlapljiv i jako toksičan. Pare RuO4 naročito oštećuju sluznicu oka. U prirodi se pojavljuje obično kao pratitelj bakarnih i nikalnih ruda, a poznata je i prirodna legura osmija i iridija koja sadrži rutenij. Upotrebljava se za legiranje platine i paladija (povećava im tvrdoću).
zaštita žrtvovanom elektrodom → sacrificial protection
Zaštita žrtvovanom elektrodom zaštita je željeza ili čelika protiv korozije koristeći reaktivniji metal. Komadići cinkove ili magnezijeve slitine pričvrste se za tijela pumpi ili cijevi. Zaštićeni metal je katoda i ne korodira dok anoda korodira. Ovakvi se predmeti zovu žrtvovane anode. Žrtvovane elektrode moraju se periodično zamjenjivati ovisno o brzini trošenja.
Željezna cijev spojena je s reaktivnijim metalom, kao što je magnezij, koji će donirati svoje elektrone i sprječiti hrđanje željeza. Eventualno oksidirano željezo će se reducirati nazad u elementarno stanje.
salinitet → salinity
Salinitet (S) je mjera za količinu otopljenih soli u morskoj vodi. Salinitet je definiran kao ukupna količina otopljenih soli u morskoj vodi u promilima, ‰, (djelovima na tisuću) kada se svi karbonati pretvore u okside, bromidi i jodidi u kloride i kada se sve organske tvari kompletno oksidiraju.
Klorinitet je najstarija metoda za mjerenje saliniteta koja, temeljem ideje o stalnom omjeru otopljenih komponenti morske vode, pruža uvid u ukupnu količinu otopljenih soli u morskoj vodi mjerenjem koncentracije halida (klorida, bromida i jodida). Odnos između kloriniteta (Cl) i saliniteta dan u Knudsenovim tablicama jest
Ova formula koristila se do 1962., kada je JPOTS (Joint Panel for Oceanographic Tables and Standards) odredilo novu konstantu proporcionalnosti u Knudsenovoj formuli
U međuvremenu, razvoj uređaja za mjerenje električne vodljivosti doveo je do brze, jeftine i precizne metode za određivanja slanosti morske vode. Uveden je Praktični salinitet (SP) kao zamjena za salinitet dobiven mjerenjem kloriniteta. Skala praktičnog saliniteta (Practical Salinity Scale 1978, PSS-78) definirana je preko K15, odnosno odnosa električne vodljivosti uzorka mora pri t68 = 15 °C i tlaku od jedne standardne atmosfere i otopine kalijevog klorida (KCl) u kojoj je maseni udio KCl točno 0.0324356 (32.4356 g KCl otopljeno je u 1 kg otopine) pri istom tlaku i temperaturi.
Praktični salinitet je bezdimenzijska veličina iako mu ponekad (pogrešno) pripisuju jedinicu "psu". U većini slučajeva može se pretpostaviti da su psu i ‰ sinonimi.
Prosječni salinitet morske vode je 35 ‰, što je oko 35 g soli otopljeno u 1 kg morske vode.
solni most → salt bridge
Solni most osigurava električni kontakt između dviju otopina bez njihovog miješanja. Solni most sastoji se od poroznog materijala koji je natopljen otopinom soli i koji dopušta ionima da prijeđu iz jedne posude u drugu. Otopina soli ostaje nepromijenjena tijekom ovog prijenosa.
Citiranje ove stranice:
Generalić, Eni. "LediÅ¡te." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav