dioksin → dioxin
Dioksini su organski spojevi koji pripadaju u grupu polikloriranih ugljikovodika, točnije polikloriranih bifenila. Najopasniji od njih je TCDD (2,3,7,8-tetraklorodibenzo-p-dioksin) ili jednostavno dioksin. Dioksin nastaje izgaranjem mnoštva organskih tvari, često i organskih otpadaka prilikom spaljivanja otpada, a i kao nusprodukt u raznim kemijskim procesima u organskoj kemijskoj industriji. U tragovima ga je bilo u poznatoj kemikaliji Agent Orange koja se upotrebljavala u Vijetnamskom ratu za defolijaciju šuma. Također je poznat iz incidenta u Tvornici kemijskih proizvoda u Sevesu u Italiji gdje je dioksin onečistio okolinu.
Dioksini su kemijski stabilni, netopljivi u vodi, ali vrlo lako topljivi u mastima i uljima. Istraživanja potaknuta tvrdnjama da je herbicid štetio vijetnamskim veteranima i radnicima u kemijskoj industriji potvrdila su visoku toksičnost, teratogenost, kancerogenost i mutagenost dioksina. U posljednje vrijeme objavljeni su i radovi u kojima se upozorava da se i neki spojevi iz ispušnih plinova automobila ponašaju slično dioksinu.
Strukturna formula izgleda ovako:
zakon o određenom sastavu → law of definite composition
Zakon o određenom sastavu kaže da se elementi u danom spoju uvijek spajaju u istom omjeru masa. Ovaj zakon je osnovni zakon u definiranju kemijskih spojeva.
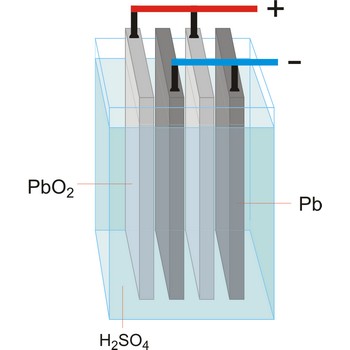
elektrolitska ćelija → electrolytic cell
Elektrolitska ćelija je ćelija u kojoj se električna energija pretvara u kemijsku. Kemijske reakcije se ne dešavaju spontano, već se odvijaju na račun struje koju u ćeliju šalje vanjski izvor i vrši elektrolizu. Promjena slobodne Gibbsove energije ukupnog procesa pozitivna je. Koriste se za elektrolizu tvari ili za spremanje električne energije pretvorbom u kemijsku (akumulatori).
nascentno stanje → nascent state
Nascentno stanje je posebno aktivno stanje elemenata u trenutku kad se oslobađa iz spoja prilikom kemijske reakcije, npr. nascentni vodik.
energija → energy
Energija (E, U) je karakteristika sustava i definirana je kao sposobnost sustava da vrši rad. Jedinica za energiju je džul (J).
Unutrašnja energija tijela zbir je potencijalne i kinetičke energije atoma i molekula koji ga sačinjavaju.
Potencijalna energija jest energija pohranjena unutar tijela ili sustava kao posljedica mjesta, oblika ili stanja (uključuje gravitacijsku, električnu, nuklearnu i kemijsku energiju).
Kinetička energija jest energija kretanja i za tijelo mase m koje ima brzinu v, iznosi mv2/2. Doprinos kinetičke energije je mnogo veći kod plinova, čije molekule imaju vrlo veliku slobodu kretanje, nego kod tekućina i čvrstih tvari.
U izoliranom sustavu energija se može pretvarati iz jednog oblika u drugi, ali ukupna energija ostaje konstantna.
eksploziv → explosive
Eksplozivi (lat. explodere - raspasti se) su kemijski spojevi ili smjese koje zagrijavanjem, udarcem, trenjem ili inicijalnim paljenjem u veoma kratkom vremenskom razmaku oslobađaju veliku količinu energije. Kod gotovo svih eksploziva kemijska je reakcija trenutna oksidacija; potrebni kisik nalazi se u molekulama samog eksploziva, npr. sumpor i ugljen u crnom barutu izgaraju na račun kisika kojega u salitri (KNO3) ima oko 50 %. Stoga sumpor i ugljen izgaraju mnogo brže u barutu nego na zraku. Kod nitroglicerina prilikom eksplozije potreban kisik daju atomske grupe NO3-. Brzina izgaranja eksploziva određuje se vremenom koje je potrebno za izgaranje jednog komada eksploziva određene dužine i naziva se brzina detonacije (mjeri se u m/s). Eksplozija je egzotermna reakcija, tj. reakcija pri kojoj se razvija toplina. Ovako razvijena energija izaziva golem učinak zbog trenutačnosti reakcije. Eksplozivi se upotrebljavaju u razne svrhe: u građevinarstvu, rudarstvu i vojnoj industriji. Razne vrste eksploziva mogu se prema primjeni svrstati u tri kategorije: barute, brizantne eksplozive i inicijalne eksplozive.
gorivi članak → fuel cell
Gorivi članci su naprave koje pretvaraju kemijsku u električnu energiju. Razlikuju se od baterija po tome što se proces pretvorbe odvija sve dotle dok se u članak dovode gorivo i oksidirajuće sredstvo, dok je baterija napravljena s ograničenom količinom kemikalija, te je ispražnjena kada sve kemikalije izreagiraju. Gorivi članak je galvanski članak u kojem se na elektrodama odvijaju spontane reakcije. Gorivo (uglavnom vodik) oksidira se na anodi, a oksidans (gotovo uvijek kisik ili zrak) reducira se na katodi.
Neki gorivi članci koriste kao elektrolit vodene otopine, on može biti kiseli ili alkalni, a može biti i ionski vodljiva membrana namočena vodenom otopinom. Ovakvi gorivi članci rade na relativno niskim temperaturama, od sobne temperature do temperature vrenja vode. Neki gorivi članci kao elektrolit koriste taline soli (posebno karbonata) i rade na temperaturi od nekoliko stotina Celzijevih stupnjeva. Drugi koriste ionski vodljive čvrste tvari a rade na temperaturama blizu 1 000 °C.
oksidacija → oxidation
Kemijske spojeve s kisikom zovemo oksidima, a samu kemijsku reakciju spajanja s kisikom, oksidacijom. Oksidacija nije samo spajanje s kisikom već se kod oksidacije oksidacijski broj atoma povisuje, a kod redukcije snizuje. Svaki proces oksidacije mora pratiti proces redukcije. Zato takve reakcije skraćeno nazivamo redoks-reakcijama.
Gibbsova slobodna energija → Gibbs free energy
Gibbsova slobodna energija (G) jest energija oslobođena ili apsorbirana u reverzibilnom procesu pri konstantnoj temperaturi i tlaku. Definirana je jednadžbom
gdje je H entalpija, S entropija a T termodinamička temperatura. Naziva se još i Gibbsova energija ili samo slobodna energija.
Promjena Gibbsove slobodne energije, ΔG, određuje smjer kemijske reakcije. Ako je ΔG neke reakcije negativan, reakcija će se spontano odvijati dok se ne uspostavi ravnotežno stanje. Kada je postignuto ravnotežno stanje, onda je ΔG = 0.
Citiranje ove stranice:
Generalić, Eni. "Kemijski spoj." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav