zasićena mast → saturated fat
Zasićene masti u čvrstom su stanju pri sobnoj temperaturi. Zasićene masti u hranu dolaze uglavnom iz životinjskih izvora (govedina, mlijeko i mliječni proizvodi, crveno meso) ali također i iz tropskih biljnih ulja (kokosovog ili palminog ulja).
skandij → scandium
Skandij je 1879. godine otkrio Lars Fredrik Nilson (Švedska). Ime je dobio prema latinskom nazivu za Skandinaviju - Scandia. Mendeljejev ga je predvidio 1869. i dao mu ime ekaboron. To je mekani, srebrno bijeli metal koji brzo potamni na zraku. Smješta se u skupinu metala rijetkih zemalja skupa s lantanoidima. Burno reagira s vodom stvarajući vodik i netopljivi skandijev hidroksid. Reagira s kisikom iz zraka i halogenima. U prirodi se javlja u lantanoidnim mineralima monacitu i gadolinitu i u rijetkom silikatu thortveititu (Sc2Si2O7). Upotrebljava se u specijalnim živinim lampama i magnezijevim legurama.
reakcije drugog reda → second-order reactions
Reakcije drugog reda reakcije su u kojima je brzina proporcionalna ili koncentraciji reaktanta na kvadrat ili umnošku koncentracija dvaju reaktanata.
Za opću unimolekularnu reakciju
izraz za reakciju drugog reda se može napisati
Ako uzmemo da je koncentracija reaktanta A u vremenu t=0 jednaka [A]o a u vremenu T jednaka [A], integriranjem gornjeg izraza može se jednostavno izračunati red reakcije
selenij → selenium
Selenij je 1817. godine otkrio Jons Jakob Berzelius (Švedska). Ime je dobio po grčkom nazivu za Mjesec - selene. To je amorfna ili kristalična crvena do siva krutina neugodnog mirisa koji se upije u kožu i teško odstranjuje. Ne reagira s vodom. Topljiv u alkalijama i nitratnoj kiselini. Gori na zraku. Metalni selenij je slab vodič električne struje, ali mu se vodljivost na svjetlu povećava i do tisuću puta. Selenij je otrovan ako se udiše ili proguta i ima kumulativni efekt. Nadražuje kožu i vjerojatno je kancerogen. Selenij je redoviti pratitelj sumpora. Dobiva se kao sporedni proizvod pri proizvodnji bakra (prženjem sulfidnih ruda). Upotrebljava se za izradu fotoelektričnih ćelija (osobito za fotokopiranje), u staklarskoj industriji za uklanjanje zelene boje i proizvodnji gume.
silicij → silicon
Silicij je 1824. godine otkrio Jöns Jacob Berzelius (Švedska). Ime je dobio po latinskom nazivu za kremen - silicis. Amorfni silicij je smeđe-crni prah, a kristalni je plavo-zelen. U kiselinama, osim fluoridne, se ne otapa ali se otapa u lužinama pri čemu se oslobađa vodik. Duže udisanje silikatnog praha može dovesti do kronične bolesti dišnog sustava. Silicij je drugi metal po rasprostranjenosti u Zemljinoj kori. Vezan s kisikom glavni je sastojak stijena i u njima se nalazi u obliku različitih silikata, ili kao čisti SiO2 - kremen. Kremeni pijesak je osnovna sirovina za proizvodnju stakla. Silicij se u metalurgiji upotrebljava za proizvodnju ferosilicija, a u elektronici za proizvodnju poluvodiča.
srebro → silver
Srebro je poznato od davnih vremena (~3000. godine prije Krista). Ime je dobilo po latinskoj riječi argentum što znači bijel, sjajan. To je bijeli metal visokog sjaja, neobično kovak i rastezljiv. Najbolji je vodič topline i električne struje od svih metala. Na zraku ne oksidira, ali nakon nekog vremena potamni zbog reakcije s tragovima sumporvodika u zraku pri čemu nastaje crni sulfid. Topljiv je samo u oksidirajućim kiselinama, kao što su vruća koncentrirana sulfatna i nitratna kiselina. Srebrni ion ima baktericidno djelovanje pa voda u srebrnoj posudi dugo ostaje svježa. Srebro se u prirodi može naći elementarno ili u obliku argenita (Ag2S). Uglavnom se dobiva kao nusproizvod pri proizvodnji olova i bakra. Služi za posrebrivanje manje plemenitih metala, za izradu ogledala i fotografskih filmova. Od srebra se izrađuje nakit i legure sa zlatom i bakrom.
natrij → sodium
Natrij je 1807. godine otkrio Sir Humphry Davy (Engleska). Još u starom zavjetu spominje se neter kao sredstvo za pranje. Arapski alkemičari promijenili su latinski naziv nitrum u natron odakle i potječe današnji naziv natrija. To je mekani, srebrno bijeli metal čija se svježe odrezana površina trenutno oksidira. Reagira burno s vodom, pri čemu se nastali vodik zbog topline reakcije sam zapali. Spada među najjača redukcijska sredstva. U Zemljinoj kori ga je toliko mnogo da je teško naći uzorak bez spojeva natrija. Najviše ga ima u raznim aluminosilikatima, kamenoj soli (NaCl) i čilskoj salitri (NaNO3). Velike količine natrijeva klorida otopljene su u moru. Elementarni natrij koristi se u organskoj sintezi, za natrijeve lampe i fotoelektrične ćelije kao i za dobivanje spojeva koji se ne mogu drukčije pripraviti.
spontani proces → spontaneous process
Spontani procesi oni su procesi koji se odvijaju bez vanjskog utjecaja. Vanjske sile nisu potrebne za održavanje procesa iako su ponekad potrebne da bi sam proces započeo. Npr. gorenje drva postaje spontani proces onog trena kad se zapali vatra. Spajanje vode i ugljikova dioksida u drvo i kisik nije spontani proces.
standardni elektrodni potencijal → standard electrode potential
Standardni elektrodni potencijal (E°) (standardni redukcijski potencijl) definiran je mjerenjem relativnih elektrodnih potencijala uz standardne uvjete (aktivitet 1, tlak 101 325 Pa i temperatura 25 °C) prema standardnoj vodikovoj elektrodi. Po konvenciji članak se piše tako da se oksidirani oblik piše prvi. Na primjer,
Elektromotorna sila gornjeg članka je -0.76 V pa je standardni elektrodni potencijal Zn2+|Zn polućelije -0.76 V.
Kada su aktiviteti oksidiranog i reduciranog oblika jednaki 1, tada je logaritamski član u Nernstovoj jednadžbi za elektrodni potencijal jednak nuli i imamo
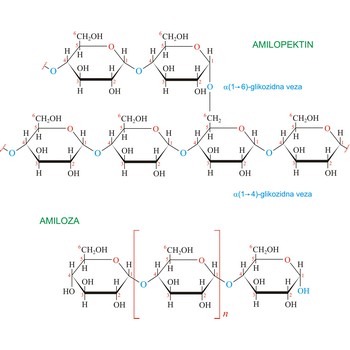
škrob → starch
Škrob C6H10O5)x je polisaharid koji biljke koriste za skladištenje molekula glukoze. Nakuplja se u plodovima, sjemenkama, gomoljima i korijenju. Škrob je smjesa dvaju različitih polimera, amiloze (oko 20 %) i amilopektina (oko 90 %). Amiloza je netopljiva u hladnoj vodi, dok je amilopektin topljiv. Amiloza se sastoji od nekoliko stotina ostataka glukoze međusobno povezanih α(1→4)-glikozidnim vezama. Amilaza s jodom daje karakteristično intenzivno ljubičasto obojenje. Amilopektin je razgranati polimer sastavljen od dugog lanca, od nekoliko tisuća, ostataka glukoze međusobno povezanih α(1→4)-glikozidnim vezama i pobočnih lanaca koji su s njima povezani α(1→6)-glikozidnim vezama (prosječno na svakih 25 ostataka glukoze). Amilopektin s jodom daje blijedocrveno obojenje.
Probava škroba započinje u ustima djelovanjem amilaze, probavnog enzima prisutnog u slini. Razgradnja se nastavlja u tankom crijevu enzimima što ih izlučuje gušterača. Konačni produkt, molekule glukoze, apsorbiraju se u krvotok i prenose do jetre. Glikozidaze su u svom djelovanju jako specifične. One mogu hidrolizirati α-glikozidnu vezu u škrobu i glikogenu ali ne i β-glikozidnu vezu u celulozi. Škrob je važan sastojak u prehrani a široko se upotrebljava i u proizvodnji ljepila, farmaciji i medicini.
Citiranje ove stranice:
Generalić, Eni. "Dlhwc-public@dol.gov." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav