kiselina → acid
Kiseline su vrsta spojeva koji sadrže vodik i disocijacijom u vodi daju pozitivne vodikove ione pri čemu je rezultirajući pH manji od 7. Reakcija za kiselinu HA može se napisati kao
Ustvari, vodikov je ion (proton) solvatiziran pa reakcija disocijacije kiseline izgleda ovako:
Ova definicija kiselina dolazi iz Arrheniusove teorije. Kiseline su tvari čije vodene otopine imaju kiseli okus, korozivne su i mijenjaju boju lakmus-papira u crvenu.
Kiseline možemo podijeliti na jake, koje potpuno disociraju u vodi (npr. sulfatna i kloridna kiselina), i slabe kiseline, koje su samo djelomično disocirane (npr. octena i sumporvodična kiselina). Jakost kiseline ovisi o stupnju disocijacije i izražava se konstantom disocijacije kiseline.
Arrheniusovu definiciju kiselina i baza proširili su J. M. Lowry i J. N. Brønsted 1923. Njihova teorija definira kiselinu kao tvar koja daje proton (proton donor), a bazu kao tvar koja je sposobna primiti proton (proton akceptor). Da bi se neka jedinka ponašala kao kiselina, mora biti prisutan proton akceptor (baza). Lowry-Brønstedova teorija kaže da kad neka kiselina dade proton, nastane konjugirana baza koja može primiti proton.
Prema Lowry-Brønstedovoj predodžbi, kad neka kiselina dade proton, uvijek nastane konjugirana baza koja može primiti proton.
Slično, od svake baze kao rezultat primitka protona nastane konjugirana kiselina.
Primjerice, acetatni ion je konjugirana baza octene kiseline, a amonijev ion je konjugirana kiselina amonijaka.
Što je kiselina konjugiranog kiselo/baznog para slabija, njezina konjugirana baza postaje jača, i obrnuto.
Najopćenitiju definiciju kiselina dao je G. N. Lewis koji sve kemijske vrste koje mogu primiti elektronski par naziva kiselinama. Ova definicija uključuje sve "tradicionalne" kiselo-bazne reakcije, ali sadrži i reakcije koje ne uključuju ione, primjerice
u kojoj je NH3 baza (donor elektronskog para) a BCl3 kiselina (akceptor elektronskog para).
Boltzmannova jednadžba → Boltzmann equation
Boltzmannova jednadžba predstavlja statističku definiciju entropije:
S je entropija, k je Boltzmanova konstanta, a W je vjerojatnost postojanja sustava u pojedinom stanju.
zakon o određenom sastavu → law of definite composition
Zakon o određenom sastavu kaže da se elementi u danom spoju uvijek spajaju u istom omjeru masa. Ovaj zakon je osnovni zakon u definiranju kemijskih spojeva.
baza → base
Povijesno gledajući (S. Arrhenius), baze su tvari koja disocirajući u otopinama daju OH- ione, pri čemu je rezultirajući pH veći od 7. Po Brønsted-Lowryjevoj teoriji baza je tvar koja je sposobna primiti proton (proton akceptor). Da bi se neka jedinka ponašala kao baza, mora biti prisutan proton donor (kiselina).
Najopćenitiju definiciju baza jdao je G. N. Lewis koji sve kemijske vrste koje mogu dati elektronski par naziva bazom. Otopine baza nazivamo lužinama.
Tipične baze su metalni oksidi, hidroksidi i spojevi (kao amonijak) koji daju hidroksid-ione u vodenim otopinama.
klorinitet → chlorinity
Klorinitet (simbol Cl) je definiran kao ukupna količina halida (klorida, bromida i jodida) u 1 kg mora, a da su pri tome jodid i bromid zamijenjeni ekvivalentnom količinom klorida. Kako bi se napravio neovisnim o promjenama atomskih masa halida, klorinitet se danas definira kao masa čistog srebra potrebna da se istalože svi kloridi, bromidi i jodidi pomnožena s 0.37285233. Klorinitet se općenito određuje kako bi se izračunala slanost (salinitet) mora.
Klorinitet se određuje Mohrovom metodom, jednom od najstarijih metoda titracije - uveo ju je 1856. njemački kemičar Karl Friedrich Mohr (1806.-1879.), titracijom uzorka mora sa standardnom otopinom srebrovog nitrata (AgNO3) uz kalijev kromat (K2CrO4) kao indikator.
pri tome se uz AgCl talože još i AgBr i AgI.
Problem kod Mhorove titracije je u tome što srebrov nitrat nije primarni standard. Kako bi ovo izbjegao i omogućio da sva mjerenja saliniteta budu usporediva, predsjednik Međunarodnog povjerenstva za istraživanje mora (ICES, International Council for the Exploration of the Sea), danski fizičar Martin Knudsen (1871.-1949.) definirao je kao standard Normalnu vodu (Eau de mer Normale) stalnog sastava s točno određenim klorinitetom (oko 19.38 ‰). Ova voda je potom korištena za standardizaciju otopine srebrova nitrata. Na taj način sva određivanja kloriniteta referirala su se na isti standard što je omogućilo da svi rezultati budu usporedivi. Upotrebom Normalne vode, Knudsenove pipete i birete za analizu te Hidrografskih tablica dobivali su se rezultati točnosti usporedive onima dobivenim gravimetrijom.
Mjerenjem saliniteta i kloriniteta u devet uzoraka mora iz različitih dijelova svijeta Knudsen je, 1889., došao do empirijske formule za određivanje saliniteta:
Ova formula koristila se do 1962., kada je Zajedničko vijeće za oceanografske tablice i standarde (JPOTS, Joint Panel for Oceanographic Tables and Standards) odredilo novu konstantu proporcionalnosti u Knudsenovoj formuli
ekološki otisak → ecological footprint
Ekološki otisak (Ecological Footprint) nam daje odnos između ljudskih zahtjeva i regenerativne sposobnosti biosfere, odnosno kazuje nam kolika površina Zemlje, u globalnim hektarima, je potrebna za smještaj naše infrastrukture (kuća, tvornica, cesta, ...), korištenje obnovljivih izvora (usjevi, riba, drvo, ...) i recikliranje otpada (trenutno je jedino CO2 uključen). Ekološki otisak odnosi se samo na obnovljive izvore. Upotreba neobnovljih izvora, kao što im samo ime kaže, nije održiva.
Ekološki otisak i biokapacitet izražavaju se u globalnim hektarima (gha). U Sjedinjenim državama ekološki otisak se često izražava i u globalnim ralima (ga). Jedan US ral jednak je 0.405 hektara.
Ekološki otisak čovječanstva 2007. iznosio je 2.7 gha po stanovniku što je 51 % više od ukupnog Zemljinog biokapaciteta (koji iznosi 11.9 milijardi gha ili 1.8 gha po osobi). Drugim riječima, čovječanstvu je već sada potreban drugi planet kao bi zadovoljio potražnju za namirnicama, energijom i drugim prirodnim sirovinama. Razvijene zemlje obično imaju puno veće zahtjeve prema Zemljinom ekosustavu od siromašnih, manje razvijenijih zemalja
elektrokemijski niz → electrochemical series
Elektrokemijski niz su kemijski elementi složeni po svom standardnom elektrodnom potencijalu. Dogovorno je uzeto da je potencijal standardne vodikove elektrode
jednak nuli pri svim temperaturama. Elektrodni potencijal po definiciji je redukcijski potencijal.
Što je negativniji standardni elektrodni potencijal, to je metal elektropozitivniji i može reducirati manje elektropozitivne elemente (elemente ispod sebe u elektrokemijskom nizu).
tvrdoća → hardness
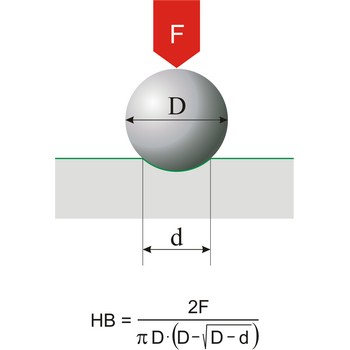
Tvrdoća je otpor materijala prema utiskivanju tijela određene veličine, oblika i poznatog opterećenja. Ova se definicija odnosi na sve tipove skala tvrdoća osim Mohrove skale, koja je zasnovana na otpornosti na grebanje i koristi se uglavnom za minerale. Najčešće korištene skale tvrdoća su: Brinellova (za lijevano željezo), Rockwellova (za lim i toplinski obrađeni čelik) i Knoop (za metale).
elektrodni potencijal → electrode potential
Elektrodni potencijal je potencijal elektrokemijske ćelije u kojoj je ispitivana elektroda spojena kao katoda a standardna vodikova elektroda (E = 0.000 V) kao anoda. Na katodi se uvijek događa redukcija a na anodi oksidacija.
Elektrodni potencijal je po definiciji redukcijski potencijal. Prema IUPAC-ovu dogovoru, izraz elektrodni potencijal namijenjen je isključivo za polureakcije napisane kao redukcije. Predznak elektrodnog potencijala određen je predznakom dotičnog polučlanka spojenog sa standardnom vodikovom elektrodom. Pozitivni predznak upućuje na to da je reakcija spontana u odnosu na standardnu vodikovu elektrodu, tj. da se polučlanak spontano ponaša kao katoda.
Članak za mjerenje elektrodnog potencijala sastoji se od standardne vodikove elektrode (dogovorno se piše lijevo)
i elektrode ispitivanog redoks-sustava (dogovorno se piše desno)
i može se shematski napisati kao
Elektromotorna sila (e.m.f.) ispitivanog redoks sustava jednaka je
Dogovorno je uzeto da je pri p(H2) = 101325 Pa i a(H+) = 1.00, potencijal vodikove elektrode jednak je 0.000 V pri svim temperaturama. Posljedica je takve definicije da se ukupni potencijal svakoga galvanskog članka koji sadrži standardnu vodikovu elektrodu pripisuje drugoj elektrodi
talište → melting point
Talište je temperatura pri kojoj čvrsta tvar prelazi u tekuće stanje pri normalnom tlaku.
Mnogo točnija definicija tališta (ili ledišta) jest da je to temperatura pri kojoj su čvrsta i tekuća faza neka tvari pri određenom tlaku u ravnoteži. Čiste tvari, za razliku od smjesa, imaju oštro definirano talište karakteristično za tu tvar. Hoće li se koristiti naziv talište ili ledište, ovisi o tome da li se tvar zagrijava ili hladi.
Citiranje ove stranice:
Generalić, Eni. "Definition of apres ski." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav