poluacetal → hemiacetal
Poluacetali ili hemiacetali organski su spojevi opće formule R2C(OH)OR’ (R’ ≠ H) dobiveni adicijom molekule alkohola na karbonilnu skupinu aldehida ili ketona. Poluacetali su općenito nestabilni spojevi a stabilnija konfiguracija nastaje kada intramolekularnom ciklizacijom nastane peteročlani furanozni ili šesteročlani piranozni prsten. Prvotno se izraz poluacetali (hemiacetali) odnosio samo na poluacetale izvedene iz aldehida (jedan R = H) ali je danas proširen i na one izvedene iz ketona (poluketale) (oba R ≠ H).
poluketal → hemiketal
Poluketali ili hemiketali organski su spojevi opće formule R2C(OH)OR (R ≠ H) dobiveni adicijom molekule alkohola na karbonilnu skupinu ketona. Ako su keto i hidroksilna skupina u sastavu istog spoja, intramolekulskom ciklizacijom nastaje ciklički poluketal. Ovaj naziv bio je odbačen, ali je vraćen u upotrebu kao podklasa poluacetala.
homologni niz → homologous series
Homologni niz je niz spojeva zajedničke opće formule u kojem se svaki član od idućeg razlikuje za istu skupinu, npr. metilensku skupinu (-CH2-). Članovi homolognog niza zovu se homolozi.
Ravnolančani alkani primjer su homolognog niza opće formule CnH2n+2
| Struktura | Ime |
|---|---|
| CH4 | metan |
| CH3-CH3 | etan |
| CH3-CH2-CH3 | propan |
| CH3-CH2CH2CH3 | butan |
| CH3-(CH2)3-CH3 | pentan |
| CH3-(CH2)4-CH3 | heksan |
| CH3-(CH2)5-CH3 | heptan |
| CH3-(CH2)6-CH3 | oktan |
| CH3-(CH2)7-CH3 | nonan |
| CH3-(CH2)8-CH3 | dekan |
vodik → hydrogen
Vodik je 1766. godine otkrio Sir Henry Cavendish (Engleska). Ime mu je dao Lavoisie od grčkih riječi hydro što znači voda i genes što znači tvoriti. To je plin bez boje i mirisa, netopljiv u vodi. Lako difundira kroz sve materijale. Zapaljiv je i pravi eksplozivne smjese u zraku. Zapaljen na zraku gori svijetlim vrućim plamenom dajući vodenu paru. Na povišenoj temperaturi lako se spaja s kisikom, sumporom i halogenim elementima. Procjenjuje se da 90 % svih atoma, odnosno skoro 3/4 mase svemira, otpada na vodik. Sve zvijezde, pa i Sunce, sastavljene su uglavnom od vodika (w>90 %). Vodik se u prirodi rijetko nalazi u elementarnom stanju, samo u višim slojevima atmosfere ili u vulkanskim plinovima. Uglavnom je vezan u spojevima od kojih su najrašireniji voda (H2O), amonijak (NH3) i razni organski spojevi. Čisti vodik se najčešće dobiva elektrolizom vode. Laboratorijski se dobiva reakcijom sulfatne kiseline i elementarnog cinka. Industrijski se dobiva prevođenjem vodene pare preko užarenog koksa. Upotrebljava se za sintezu amonijaka, hidriranje ugljena i ulja, proizvodnju kloridne kiseline i kao redukcijsko sredstvo.
metalni hidrid → metal hydride
Metalni hidridi su spojevi metala s vodikom u kojima vodik ima stupanj oksidacije -1.
indikator → indicator
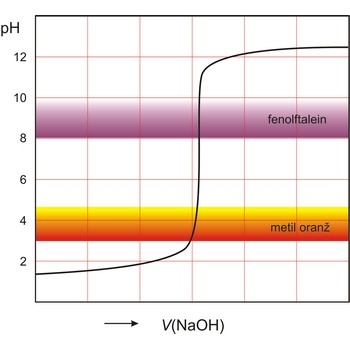
Indikator je tvar koja u otopini daje vidljivu promjenu (obično promjenu boje) u prisutnosti kemijske vrste. Koriste se za označavanje završetka kemijske reakcije. Indikatori se dijele prema vrstama kemijskih reakcija u kojima se primjenjuju (kiselo-lužnate, redoks, taložne, kompleksirajuće i adsorpcijske).
Kiselo-bazni indikatori su spojevi, kao npr. fenolftalein i metil oranž, koji reverzibilno mijenjaju boju ovisno o tome je li otopina kisela ili bazna. Oksidacijsko-redukcijski indikatori su tvari koje reverzibilno mijenjaju boju između svog oksidiranog i reduciranog oblika.
indij → indium
Indij su 1863. godine otkrili Ferdinand Reich i Hieronymus Theodor Richter (Njemačka). Ime je dobio po karakterističnoj indigoplavoj liniji u vidljivom dijelu atomskog spektra. To je srebrno bijeli metal, mekan poput voska koji je stabilan na zraku i u vodi. Topljiv je u kiselinama uz razvijanje vodika. Spojevi indija, naročito ako su u koloidnom stanju, su toksični ako se progutaju. Indij je rijedak metal koji se nigdje ne javlja u većim količinama. Dobiva se kao nusproizvod prerade sulfidnih ruda cinka, željeza i bakra. Upotrebljava se u elektronici, legura In-Cd-Ag se koristi za izradu kontrolnih šipki u nuklearnom reaktoru. Spojevi indija upotrebljavaju se za proizvodnju infracrvenih detektora.
ionski izmjenjivač → ion exchanger
Ionski izmjenjivači su visokopolimerni spojevi koji imaju svojstvo da vežu ione iz otopine, a pri tome oslobađaju ekvivalentnu količinu istoimeno nabijenih iona. Ion izmjenjivačke smole sadrže različite kopolimere čvrsto vezane u trodimenzionalanu strukturu na koju su pričvršćene ionske skupine. Ovisno o strukturi imamo kationske i anionske izmjenjivače. Upotrebljavaju se za prečišćavanje različitih otopina, lijekova, demineraliziranje vode i dr.
iridij → iridium
Iridij je 1803. godine otkrio Smithson Tennant (Engleska). Ime je dobio po latinskoj riječi iris što znači duga jer su mu spojevi jako obojeni. To je sjajni, vrlo tvrdi, srebrni metal. Zajedno s osmijem i platinom čini skupinu teških platinskih metala. Ni jedna vodena otopina ga ne napada. Razara ga tek rastaljena lužina. Na zraku se nezaštićen može zagrijati do 2300 °C. Zbog njegove otpornosti na koroziju, od njegove legure je izrađen prametar (90 % Pt i 10 % Ir). U prirodi se pojavljuje obično kao pratitelj bakarnih i nikalnih ruda, ili kao osmiridij (prirodna legura osmija i iridija) koja sadrži rutenij. Upotrebljava se za legiranje platine i paladija (povećava im tvrdoću).
Citiranje ove stranice:
Generalić, Eni. "Alicikli�ki spojevi." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav