racematna smjesa → racemic mixture
Racematna smjesa je mješavina ljevokretnih i desnokretnih optički aktivnih izomera u jednakim količinama. Zato što svaki enantiomer zakreće polarizirao svjetlo u suprotnom smjeru, racematna smjesa ne zakreće polarizirala svjetlo. Ove mješavine se označavaju s ± ili d-.
laktoza → lactose
Laktoza (mliječni šećer) je didsaharid koji se sastoji od jedne molekule glukoze povezane s galaktozom β(1→4)-glikozidnom vezom. Laktoza je beta acetal. Javlja se samo u mlijeku sisavaca gdje je ima o 4 % do 7 %. Netolerancija na laktozu česta je bolest koja rezultira proljevom, bolovima u trbuhu i nadutošću a uzrokovana je smanjenom aktivnošću enzima laktaze.
Laktoza je, kao i celebioza i maltoza, reducirajući šećer. Svi reducirajući šećeri pokazuju mutarotaciju kada se otope u vodi. Ravnotežna smjesa pri 20 °C sastoji se od 62.7 % β-laktoze (β-D-galaktopiranozil-(1→4)-β-D-glukopiranoze) i 37.3 % α-laktoze (β-D-galaktopiranozil-(1→4)-α-D-glukopiranoze).
lizin → lysine
Lizin je nabijena aminokiselina s baznim pobočnim lancem. Amino skupina u pobočnom lancu je vrlo reaktivna i često je dio aktivnog mjesta u enzimima. Lizin ima značajnu ulogu u koordinaciji negativno nabijenih liganada. To je esencijalna aminokiselina koju ljudski organizam ne može sintetizirati te se mora unijeti preko hrane.
- Kratice: Lys, K
- IUPAC ime: 2,6-diaminoheksanska kiselina
- Molekularna formula: C6H14N2O2
- Molekularna masa: 146.19 g/mol
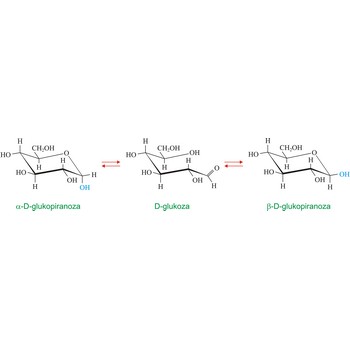
mutarotacija → mutarotation
Mutarotacija je promjena optičke aktivnosti uzrokovana epimerizacijom. U kemiji ugljikohidrata ovaj termin obično se odnosi na epimerizaciju anomernog ugljikovog atoma. U vodenoj otopini postiže se ravnotežna smjesa dvaju anomera koji prelaze jedan u drugi preko otvorenog aldehidnog oblika. Otapanjem čiste α-D-glukopiranoze ([α]D = +112.2°) ili čiste β-D-glukopiranoze ([α]D = +18.7°)u vodi dolazi do promjene zakretanja svjetlosti koje na kraju uvijek iznosi [α]D = +52.6deg;. U ravnoteži se nalazi 36 % α- i 64 % β-oblika dok je aldehidni oblik prisutan u jako niskoj koncentraciji. Mutarotaciju je 1846. otkrio francuski kemičar Augustin-Pierre Dubrunfaut (1797.-1881.).racemizacija → racemisation
Racemizacija je proces konverzije, toplinom ili kemijskom reakcijom, optički aktivnog spoja u optički neaktivni oblik koji sadrži 50 % ljevokretnog i 50 % desnokretnog optički aktivnog izomera (enantiomera).
regeneracija → regeneration
Regeneracija je proces obnavljanja ionskog izmjenjivača i njegovo ponovno dovođenje u aktivno stanje nakon iscrpljenosti. Kationski izmjenjivači obično se regeneriraju kloridnom kiselinom a anionski natrijevim kloridom
fosfor → phosphorus
Fosfor je 1669. godine otkrio Hennig Brandt (Njemačka). Ime mu dolazi od grčke riječi phosphoros što znači donošenje (rađanje) svjetlosti. Fosfor se javlja u tri alotropske modifikacije. Bijeli fosfor je bijela do žuta mekana voštana krutina s nagrizajućim parama koja se ne otapa u vodi ali se otapa u mastima i uljima. Na zraku se sam od sebe zapali. Mekan je a u mraku svjetluca. Crveni fosfor je stabilan i netopljiv u svim otapalima. Crni fosfor je vrlo postojana krutina metalnog sjaja. Crveni fosfor nije otrovan, dok je bijeli vrlo otrovan. Udisanje njegovih para je, i u vrlo malim količinama, smrtonosno. U dodiru s kožom izaziva duboke opekline koje teško zarastaju. U prirodi se najčešće javlja u mineralima fosforitu (Ca3(PO4)2) i apatitu (3Ca3(PO4)2·Ca(ClF)2). Dobiva se iz fosforita prženjem s kvarcnim pijeskom i ugljenom u električnim pećima. Bijeli fosfor se upotrebljava kao otrov za štakore, a crveni u industriji šibica.
otrov → poison
Otrovi su tvari koje kontaktom ili unošenjem u organizam slabe ili onemogućavaju normalne metaboličke procese i tako mijenjaju normalno funkcioniranje organa ili tkiva
Otrovi su tvari ili molekule koje se skupljaju na površini katalizatora i time blokiraju pristup aktivnim centrima ili uništavaju njihovu aktivnost.
Otrovi su tvari koje apsorbiranjem neutrone i time smanjuju nuklearnu reakciju. Prevelika količina otrova može potpuno zaustaviti lančanu reakciju.
Citiranje ove stranice:
Generalić, Eni. "Aktivni ugljen." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav