Rezultati 131–140 od 792 za Startseite Charts Anmelden Tools Schlagw%F6rter Mitgliederbereich language:en
standardni elektrodni potencijal → standard electrode potential
Standardni elektrodni potencijal (E°) (standardni redukcijski potencijl) definiran je mjerenjem relativnih elektrodnih potencijala uz standardne uvjete (aktivitet 1, tlak 101 325 Pa i temperatura 25 °C) prema standardnoj vodikovoj elektrodi. Po konvenciji članak se piše tako da se oksidirani oblik piše prvi. Na primjer,
Elektromotorna sila gornjeg članka je -0.76 V pa je standardni elektrodni potencijal Zn2+|Zn polućelije -0.76 V.
Kada su aktiviteti oksidiranog i reduciranog oblika jednaki 1, tada je logaritamski član u Nernstovoj jednadžbi za elektrodni potencijal jednak nuli i imamo
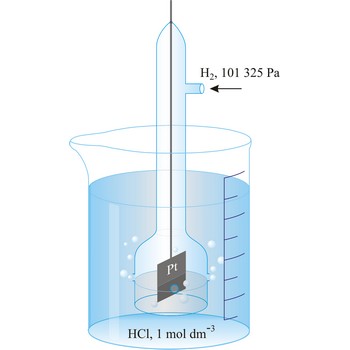
standardna vodikova elektroda → standard hydrogen electrode
Standardna vodikova elektroda sastoji se od elektrode od spužvaste platine uronjene u otopinu vodikovih iona aktiviteta 1 kroz koju se propušta plinoviti vodik pod tlakom od 101 325 Pa. Standardna vodikova elektroda u članku dogovorno se prikazuje uvijek lijevo
Redoks-potencijal standardne vodikove elektrode, pri svim temperaturama, dogovorno je uzet kao 0.
superkritična fluidna ekstrakcija → supercritical fluid extraction
Superkritična fluidna ekstrakcija (SFE) je slična ekstrakciji s organskim otapalima ali s boljom difuzijom, nižom viskoznošću i manjom napetošću površine. Glavne prednost upotrebe superkritičnih fluida za ekstrakciju su niska cijena, neotrovnost i mnogo jednostavnije i jeftinije uklanjanje otapala nego kod ekstrakcije s organskim otapalima. SFE je jednostavno najbolja tehnologija za ekstrakciju osjetljivih materijala. Suprekritični ugljikov dioksid (scCO2) se upotrebljava za ekstrakciju kofeina iz kave i čaja. Pri tome on prodire duboko u zeleno zrno i otapa od 97 % do 99 % prisutnog kofeina.
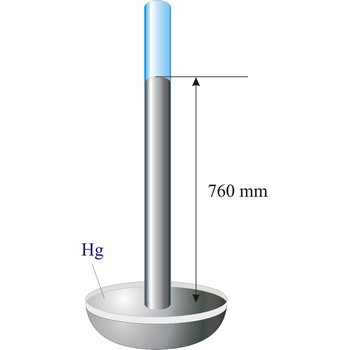
Torricelli, Evangelista → Torricelli, Evangelista
Evangelista Torricelli (1852.-1908.) je talijanski fizičar i matematičar. On je prvi uspio stvoriti stalni vakuum i izumio je barometar (1643.). Staklenu cijev, zatvorenu na jednom kraju, napunio je živom i pažljivo uronio otvorenim krajem u posudu sa živom. Živa u cijevi se spustila ostavljajući vakuum u cijevi iznad nje. Otkrio je da visina stupca žive varira ovisno o atmosferskom tlaku. Također je konstruirao brojne i kvalitetne leće.
prijelazni element → transition metal
Prijelazni elementi smješteni su središnjem dijelu periodnog sustava, u skupinama od 3. do 11. Popunjavaju d-podljuske prethodne ljuske, te ih zbog toga nazivamo i d-elementima.
Prvom nizu prijelaznih elemenata pripadaju skupine skandija (Sc), titanija (Ti), vanadija (V), kroma (Cr), mangana (Mn), željeza (Fe), kobalta (Co), nikla (Ni) i bakara (Cu). Često se i elementi 12. skupine (skupine cinka) svrstavaju u prijelazne elemente iako su d-podljuske već popunjene kod skupine bakra.
Unutar 6. i 7. periode nalaze se, u 3. podljusci, unutrašnji prijelazni elementi, (lantanoidi) i (aktinoidi). Prijelazni elementi su metali velike gustoće, tvrdoće i visokog tališta. Spojevi su im obično obojeni, a za njih je karakteristično stvaranje kompleksnih spojeva.
valentni elektron → valence electron
Valentni elektroni su elektroni koji se mogu aktivno uključiti u kemijsku promjenu. Obično su to elektroni iz zadnje (valentne) ljuske. Npr. osnovna elektronska konfiguracija natrija jest 1s2 2s2 2p6 3s1, 3s elektron jedini je valentni elektron u atomu. Germanij (Ge) ima sljedeću osnovnu elektronsku konfiguraciju 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p2, gdje su 4s i 4p elektroni valentni.
Zeemanov efekt → Zeeman effect
Zeemanov efekt je dijeljenje spektralnih linija koje nastaje kada se na izvor svjetla djeluje magnetskim poljem. Otkrio ga je 1896. nizozemski fizičar Pieter Zeeman (1865.-1943.) kao dijeljenje žute D-linije natrija u jakom magnetskom polju.
Zeemanov efekt je pomogao fizičarima da odrede energijske nivoe u atomu. U astronomiji, upotrebljava se za mjerenje magnetskog polja Sunca i drugih zvijezda.
CO2 ion selektivna elektroda → CO2 ion selective electrode
Ion selektivna elektroda za mjerenje koncentracije ugljikovog dioksida koristi hidrofobnu, CO2 propusnu membranu koja odvaja unutrašnju otopinu od otopine uzorka. Otopljeni ugljikov dioksid iz uzorka prolazit će kroz membranu sve dotle dok se ne uspostavi ravnoteža između parcijalnih tlakova CO2 u vanjskoj i unutrašnjoj otopini. Difuzija CO2 kroz membranu utječe na koncentraciju hidronijevog iona u unutrašnjoj otopini prema reakciji
Koncentracija H+ iona u unutrašnjoj otopini mjeri se staklenom elektrodom. Unutrašnja otopina sadrži visoku koncentraciju natrijeva bikarbonata (npr. 0.1 mol/L NaHCO3) kako bi količina bikarbonata ostala konstantna tijekom mjerenja.
halkogeni elementi → chalcogens
U 16. skupinu periodnog sustava spadaju kisik (O), sumpor (S), selenij (Se), telurij (Te) i polonij (Po). Zajedničkim imenom nazivaju se halkogenima (oni koji tvore rude) jer su najviše zastupljeni u rudama.
Citiranje ove stranice:
Generalić, Eni. "Startseite Charts Anmelden Tools Schlagw%F6rter Mitgliederbereich language:en." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav