klorinitet → chlorinity
Klorinitet (simbol Cl) je definiran kao ukupna količina halida (klorida, bromida i jodida) u 1 kg mora, a da su pri tome jodid i bromid zamijenjeni ekvivalentnom količinom klorida. Kako bi se napravio neovisnim o promjenama atomskih masa halida, klorinitet se danas definira kao masa čistog srebra potrebna da se istalože svi kloridi, bromidi i jodidi pomnožena s 0.37285233. Klorinitet se općenito određuje kako bi se izračunala slanost (salinitet) mora.
Klorinitet se određuje Mohrovom metodom, jednom od najstarijih metoda titracije - uveo ju je 1856. njemački kemičar Karl Friedrich Mohr (1806.-1879.), titracijom uzorka mora sa standardnom otopinom srebrovog nitrata (AgNO3) uz kalijev kromat (K2CrO4) kao indikator.
pri tome se uz AgCl talože još i AgBr i AgI.
Problem kod Mhorove titracije je u tome što srebrov nitrat nije primarni standard. Kako bi ovo izbjegao i omogućio da sva mjerenja saliniteta budu usporediva, predsjednik Međunarodnog povjerenstva za istraživanje mora (ICES, International Council for the Exploration of the Sea), danski fizičar Martin Knudsen (1871.-1949.) definirao je kao standard Normalnu vodu (Eau de mer Normale) stalnog sastava s točno određenim klorinitetom (oko 19.38 ‰). Ova voda je potom korištena za standardizaciju otopine srebrova nitrata. Na taj način sva određivanja kloriniteta referirala su se na isti standard što je omogućilo da svi rezultati budu usporedivi. Upotrebom Normalne vode, Knudsenove pipete i birete za analizu te Hidrografskih tablica dobivali su se rezultati točnosti usporedive onima dobivenim gravimetrijom.
Mjerenjem saliniteta i kloriniteta u devet uzoraka mora iz različitih dijelova svijeta Knudsen je, 1889., došao do empirijske formule za određivanje saliniteta:
Ova formula koristila se do 1962., kada je Zajedničko vijeće za oceanografske tablice i standarde (JPOTS, Joint Panel for Oceanographic Tables and Standards) odredilo novu konstantu proporcionalnosti u Knudsenovoj formuli
Le Chatelierov princip → Le Chatelier’s principle
Promijene li se vanjski uvjeti sustava, koji se nalazi u ravnoteži, tada se ravnoteža pomiče u smjeru ponovnog uspostavljanja prvobitnih uvjeta. Princip je prvi put iznio 1888. francuski kemičar Henri Le Chatelier (1850.-1936.).
morska milja → nautical mile
Morska milja (ili nautička milja) iznimno je dopuštena jedinica duljine izvan SI koja se koristi u pomorskom, riječnom i zračnom prometu. Morska milja jednaka je duljini luka jedne minute na površini Zemlje mjereno na geografskoj širini N 45° i iznosi 1852 m.
Curie → Curie
Curie, obitelj francuskih znanstvenika:
Maria Curie-Sklodowska (1867.-1934.) bila je kemičarka i fizičarka, rodom Poljakinja. Studirala je u Parizu gdje se zajedno sa suprugom Pierrom posvetila istraživanju radioaktivnosti. Poslije Pierreove smrti nasljeđuje ga kao profesorica fizike na Sorboni. Iz velike mase uranova smolinca kemijskim putem izolirala vrlo malu količinu novog metala radija koji je milijun puta radioaktivniji od urana (1898.). Drugo je njezino otkriće radioaktivni element, nazvan u čast njezine domovine polonij. 1903. podijeljena je Nobelova nagrada za fiziku supruzima Curie i H. Becquerelu, a 1911. je Maria Curie sama dobila ovu nagradu za kemiju.
Pierre Curie (1859.-1906.) bio je fizičar. Osim radova koje je dao zajedno sa svojom suprugom, otkrio je (1902.) zakon radioaktivnog raspadanja. Našao je da radij stvara neprestano toplinu, otkrio je načelo simetrije u kristalografiji, aperiodičku analitičku vagu i dr.
Curiejeva temperatura → Curie temperature
Curiejeva temperatura ili Curiejeva točka je temperatura na kojoj materijal postaje paramagnetičan. Povećanjem temperature oscilacije atoma i iona u kristalnoj rešetki tako su velike da dolazi do proizvoljne orijentacije rezultirajućih magnetnih momenata i metal prestaje biti feromagnetičan. Za željezo to se događa na temperaturi od 760 °C a kod nikla na 356 °C. Ime je dobila u čast francuskog fizičara Pierrea Curiea (1859.-1906.).
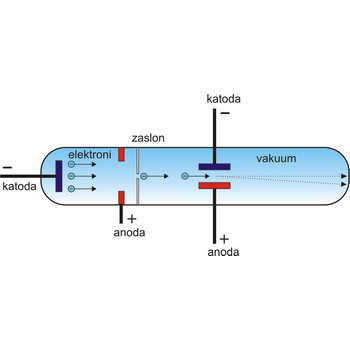
elektron → electron
Elektroni su elementarne čestice s negativnim električnim nabojem od (1.602 189 2±0.000 004 6)×10-19 C i 1/1837 mase protona, odnosno (9.109 534±0.000 047)×10-31 kg.
Elektron je 1897. otkrio engleski fizičar J.J. Thompson (1856.-1940.). On je ustanovio da prilikom provođenja elektrike kroz veoma razrijeđene plinove u Crookesovoj cijevi nastaju nevidljive zrake koje se od katode šire u pravcu i pod čijim utjecajem mnoge tvari fluoresciraju. Te zrake, katodne zrake, sastoje se od negativno nabijenih čestica koje se mogu skrenuti djelovanjem električnog i magnetskog polja.
Elektroni u atomu smješteni su u sedam ljuski oko jezgre, a maksimalni broj elektrona u svakoj ljusci ograničen je fizikalnim zakonima (2n2). Vanjska ljuska nije uvijek popunjena: natrij ima dva elektrona u prvoj ljusci (2×12 = 2), osam u drugoj (2×22 = 8) i samo jedan u trećoj ljusci (2×32 = 18). Elektron iz vanjske ljuske može prijeći u nepopunjenu ljusku drugog elementa ostavljajući atom pozitivno nabijenim. Valentni elektroni su oni elektroni koji mogu biti zarobljeni od drugog atoma ili dijeljeni s drugim atomom.
Elektroni mogu biti izbačeni iz atoma toplinom, svjetlošću, električnom energijom ili bombardiranjem visokoenergetskim česticama. Slobodni elektroni koji se spontano emitiraju raspadom radioaktivnih jezgri nazivaju se β-česticama.
Planckova konstanta → Planck constant
Planckova konstanta (h) jedna je od temeljnih prirodnih konstanti koja pomnožena s frekvencijom zračenja daje energiju sadržanu u jednom kvantu.
Njezina je vrijednost 6.626 075 5(40)·10-34 J s. Ime je dobila po njemačkom fizičaru Max Plancku (1858.-1947.).
Fischer-Tropschov postupak → Fischer-Tropsch process
Fischer-Tropschov postupak jest industrijska metoda dobivanja ugljikovodika iz ugljikova monoksida i vodika. Postupak, razvijen 1933. su Nijemci primijenili za dobivanje motornih goriva u II. svjetskom ratu. Naziv je dobio po njemačkom kemičaru Franzu Fischeru (1852.-1932.) i češkom kemičaru Hansu Tropschu (1839.-1935.). Vodik i ugljikov monoksid miješaju se u omjeru 2:1 i prevode pri temperaturi od 200 °C preko nikla ili kobalta kao katalizatora. Dobivena smjesa ugljikovodika može se razdijeliti u dizelsku i benzinsku frakciju.
Citiranje ove stranice:
Generalić, Eni. "철종2년 1851." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav