kinetička teorija → kinetic theory
Kinetička teorija objašnjava ponašanje krutina, tekućina i plinova i njihove promjene stanja, ovisno o gibanju čestica od kojih su sastavljene.
zakon o kemijskoj ravnoteži → law of chemical equilibrium
Zakon o kemijskoj ravnoteži kaže da je brzina kojom neka tvar reagira proporcionalna njenoj aktivnoj masi (molarnoj koncentraciji). Tako je brzina kemijske reakcije proporcionalna umnošku koncentracija reaktanata.
zakon o određenom sastavu → law of definite composition
Zakon o određenom sastavu kaže da se elementi u danom spoju uvijek spajaju u istom omjeru masa. Ovaj zakon je osnovni zakon u definiranju kemijskih spojeva.
Le Chatelierov princip → Le Chatelier’s principle
Promijene li se vanjski uvjeti sustava, koji se nalazi u ravnoteži, tada se ravnoteža pomiče u smjeru ponovnog uspostavljanja prvobitnih uvjeta. Princip je prvi put iznio 1888. francuski kemičar Henri Le Chatelier (1850.-1936.).
Hessov zakon → Hesse’s law
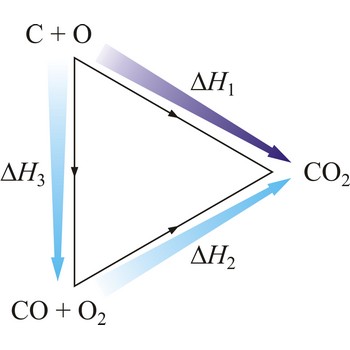
Zakonitost termokemijskih pojava otkrio je 1840. ruski kemičar švicarskog porijekla Germain Henri Hess (1802.-1850.). Njegov zakon glasi: Reakcijska toplina neke kemijske promjene ne ovisi o putu kojim reakciju vodimo, već samo o početnom i konačnom stanju sustava. Hessov zakon poznat je i kao zakon o stalnosti zbroja toplina reakcije.
Na primjer, eksperimentalno je određena entalpija oksidacije grafita u ugljikov dioksid i ugljikova monoksida u ugljikov dioksid. Zbog ravnoteže
nije moguće odrediti entalpiju oksidacije grafita u ugljikov monoksid. Međutim, reakcijska toplina te reakcije može se izračunati primjenom Hessovog zakona.
| C(s) + O2(g) →← CO2(g) | ΔrH1 = -393 kJ mol-1 |
| CO(g) + 1/2O2(g) →← CO2(g) | ΔrH2 = -283 kJ mol-1 |
| C(s) + 1/2O2(g) →← CO(g) | ΔrH3 = -110 kJ mol-1 |
jednadžba stanja idealnog plina → ideal gas law
Jednadžba stanja idealnog plina izvedena je kombinacijom Boyle-Mariotteova, Charles-Gay-Lussacova i Avogadrova zakona. Stanje idealnog plina određeno je tlakom, volumenom, množinom i temperaturom. Njihova međusobna ovisnost dana je jednadžbom
gdje je p tlak, V molarni volumen, T temperatura a R opća plinska konstanta s vrijednošću 8.314 JK-1mol-1).
tekući kristal → liquid crystal
Tekući kristali su tvari u fizikalnom stanju koje je između kristalnog stanja i taline. To stanje se zove mezofaza, a nastaje pri točki taljenja. Najvažnije mezofaze su nematična, holesterična i smektična koje se razlikuju po molekulskim orijentacijama.
magnetokemija → magnetochemistry
Magnetokemija je grana fizikalne kemije koja proučava odnose između magnetizma i kemijske građe tvari.
manganometrija → manganometry
Manganometrija je kvantitativna oksidometrijska metoda koja se temelji na mjerenju količine otopine kalijeva permanganata (KMnO4) utrošene za oksidaciju ispitivane tvari.
Citiranje ove stranice:
Generalić, Eni. "States of matter." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav