aktinoidi → actinides
Aktinoidi (aktinidi) su smješteni unutar 7. periode u 3. podljusci. Imaju nepopunjene niže f-podljuske te se stoga nazivaju unutrašnji prijelazni elementi ili f-elementima. U skupinu aktinoida spadaju elementi od rednog broja 90 do rednog broja 103, a često se u aktinoide svrstava i aktinij (Ac). U skupinu aktinoida spadaju: torij (Th), protaktinij (Pa), uranij (U), neptunij (Np), plutonij (Pu), amercij (Am), kurij (Cm), berkelij (Bk), kalifornij (Cf), einsteinij (Es), fermij (Fm), mendelevij (Md), nobelij (No) i lawrencij (Lr). Svi poznati izotopi ovih elemenata radioaktivni su. Samo se Th i U u prirodi javljaju u znatnijim količinama. Tragovi Pa, Np i Pu pronađeni su u uranijevim i torijevim rudama a veće količine dobivaju se iz nuklearnih reaktora.
americij → americium
Americij su 1944. godine otkrili Glenn T. Seaborg, Ralph A. James, Stanley G. Thompson i Albert Ghiorso (USA). Ime mu dolazi od engleske riječi za Ameriku. To je sintetski radioaktivni srebrni metal. Otporan je na alkalije. Reagira s kiselinama, zrakom i vodenom parom. Americij je otrovan i radiotoksičan element. Americij nastaje u nuklearnim reaktorima bombardiranjem plutonija-239 neutronima.
antičestica → antiparticle
Antičestica je čestica koja ima istu masu kao dana elementarna čestica i naboj koji je jednak po iznosu ali suprotnog predznaka.
atomski broj → atomic number
Atomski ili protonski broj (Z) je broj protona sadržanih u atomskoj jezgri. Redni broj elementa jednak je atomskom broju. Označuje se kao lijevi subskript (2He).
bioelement → bioelement
Bioelementi (bio + element) su kemijski elementi od kojih se sastoje živa bića i koji vrše određene funkcije u organizmima. Danas je poznato oko 60 bioelemenata.
Bravaisova rešetka → Bravais lattice
Bravaisova rešetka je beskrajni niz zasebnih točaka čiji se raspored i orijentacija ponavlja iz koje god točke niza se gledalo. Francuski kristalograf Auguste Bravais (1811.-1863.) ustanovio je da se u prostoru mogu konstruirati samo četrnaest različitih prostornih rešetki. Svi kristalni materijali mogu se uklopiti u jedan od ovih rasporeda.
|
Kristalni sustav
|
Bravaisove kristalne rešetke
|
|||
|
kubični a=b=c α=β=γ=90° |
 |
 |
 |
|
|
|
jednostavna kubična
|
prostorno centrirana kubična
|
plošno centrirana kubična
|
|
|
tetragonski a=b≠c α=β=γ=90° |
 |
 |
||
|
|
jednostavna tetragonska
|
prostorno centrirana tetragonska
|
||
|
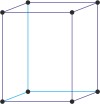
ortorompski a≠b≠c α=β=γ=90° |
 |
 |
 |
 |
|
|
jednostavna ortorompska
|
bazno centrirana ortorompska
|
prostorno centrirana ortorompska
|
plošno centrirana ortorompska
|
|
monoklinski a≠b≠c α=γ=90°≠β |
 |
 |
||
|
|
jednostavna monoklinska
|
bazno centrirana monoklinska
|
||
|
heksagonski a=b≠c α=β=90° γ=120° |
 |
|||
|
|
heksagonska
|
|||
|
romboedarski a=b=c α=β=γ≠90° |
 |
|||
|
|
romboedarska
|
|||
|
triklinski a≠b≠c α≠β≠γ≠90° |
 |
|||
|
triklinska
|
||||
alkalijski metal → alkali metal
Alkalijski metali su elementi 1. skupine periodnog sustava: litij (Li), natrij (Na), kalij (K), rubidij (Rb), cezij (Cs) i francij (Fr).. Imaju malu gustoću i toliko su mekani da se mogu rezati nožem. Svi su metali i burno reagiraju s vodom razvijajući toplinu i vodik. Reaktivnost im raste porastom atomske mase. Jednovalentni su i gotovo sve njihove soli lako su topljive u vodi. Grade jake baze koje potpuno disociraju na ione. Pridjev alkalni daje se svim tvarima s jako izraženim lužnatim osobinama.
zemnoalkalijski metal → alkaline earth metal
Zemnoalkalijski metali su elementi 2. skupine periodnog sustava: berilij (Be), magnezij (Mg), kalcij (Ca), stroncij (Sr), barij (Ba) i radij (Ra). U vanjskoj ljusci imaju dva elektrona i uglavnom se pojavljuju u oksidacijskom stanju +2. Svi su metali male gustoće i vrlo reaktivni iako manje od alkalijskih metala. Reaktivnost im raste porastom atomske mase. Berilijev hidroksid je praktično netopljiv u vodi a topljivost ostalih hidroksida raste s porastom atomske mase metala. Nazvani su zemnoalkalijskim jer vodene otopine njihovih oksida ("zemlje") imaju lužnatu (alkalnu) reakciju.
alotrop → allotrope
Alotropi su elementi koji se mogu javiti u dva ili više modifikacija u istom agregatnom stanju. Alotropi obično imaju različita fizikalna svojstva a često su im i kemijska svojstva različita.
Dijamant, grafit i fuleren su tri alotropske modifikacije elementa ugljika. Grafit je mekana, crna tvar koja vodi struju a dijamant je najtvrđa poznata tvar, proziran je i izolator. Ta dva alotropa ugljika razlikuju se jedan od drugoga po kristalnom obliku. Dijamant kristalizira u teseralnom a grafit u heksagonskom sustavu. Ugljikovi atomi u fulerenskoj molekuli raspoređeni su unutar peterokuta i šesterokuta i čine šuplju kuglu koja se sastoji od 60 i više ugljikovih atoma.
U nekim slučajevima alotropi su stabilni samo u određenom temperaturnom području koje je definirano temperaturom pretvorbe pri kojoj jedan alotrop prelazi u drugi. Primjerice, bijeli (metalni) kositar stabilan je ispod 13.2 °C a sivi (nemetalni) kositar stabilan je iznad 13.2 °C.
Izraz alotrop koristi se i za različite molekularne oblike nekog elementa. Elementarni kisik ima dvije alotropske modifikacije: obični kisik i kemijski aktivniji troatomni kisik - ozon.
Citiranje ove stranice:
Generalić, Eni. "Periodic table of the elements." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav

