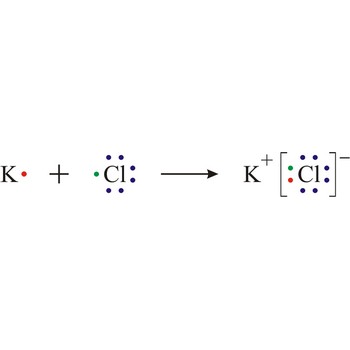olovo → lead
Olovo je poznato od davnih vremena (~1000. godine prije Krista). Ime je dobio od latinske riječi plumbum što znači tekuće srebro. To je mekani, mutno sivi metal koji potamni na zraku od stvorenog zaštitnog sloja oksida i karbonata. Otporan je na koroziju a topljiv je samo u oksidirajućim kiselinama, kao što je nitratna. Netopljiv je u sulfatnoj kiselini do masenog udjela 80 % zbog stvaranja netopljivog PbSO4. Olovo je vrlo otrovan metal, naročito opasan zbog svog kumulativnog efekta. Spojevi su mu također otrovni ako se unesu u organizam. Olovo se najčešće pojavljuje u obliku sulfida kao mineral galenit (PbS), a rjeđe u obliku ceruzita (PbCO3), anglezita (PbSO4) i krokoita (PbCrO4). Upotrebljava se za izradu cijevi za kanalizaciju, oblaganje kablova i izradu olovnih akumulatora. Od olova se izrađuju i štitovi protiv zračenja.
leucin → leucine
Leucin je hidrofobna aminokiselina s alifatskim pobočnim lancem. To je jedna od tri aminokiseline koje imaju razgranati pobočni lanac (druge dvije su valin i izoleucin). Ovaj lanac nije reaktivan ali igra važnu ulogu u stabiliziranju bjelančevina svojim hidrofobnim interakcijama. Razgranate bjelančevine čine do 25 % sadržaja prosječne bjelančevine. Leucin je esencijalna aminokiselina koju ljudski organizam ne može sintetizirati te se mora unijeti preko hrane.
- Kratice: Leu, L
- IUPAC ime: 2-amino-4-metilpentanska kiselina
- Molekularna formula: C6H13NO2
- Molekularna masa: 131.17 g/mol
Lewisova struktura → Lewis structure
Lewisova struktura način je prikazivanja rasporeda elektrona u atomima, ionima ili molekulama na način da se valentni elektroni prikazuju kao točkice smještene oko simbola elementa.
Lewisovi simboli → Lewis symbols
Lewisovim simbolima slikovito se prikazuje struktura molekula. Valentni elektroni prikazani su točkama oko simbola atoma.
ligand → ligand
Ligandi su molekule ili ioni koji se s centralnim metalnim ionom vezuju u kompleks. Ligandi mogu biti ioni ili molekule koji imaju slobodne elektronske parove. Takvi ioni jesu: fluorid (F-), klorid (Cl-), bromid (Br-), jodid (I-), sulfid (S2-), cijanid (CN-), tiocijanat (NCS-), hidroksid (OH-), peroksid (O22-), nitrozil (NO+), nitrit (NO2-), amid (NH2-), karbonat (CO32-), tiosulfat (S2O32-). Molekule su: amonijak (NH3), voda (H2O), dušikov monoksid (NO), ugljikov monoksid (CO). Ligandi se klasificiraju prema broju veza koje mogu ostvariti s centralnim atomom. Ligandi s jednim potencijalnim donorom elektrona su monodentatni ligandi s više polidentatni ligandi. Ligandi s više donorskih atoma koji se mogu vezati s centralnim atomom samo preko jednog od njih nazivaju se ambidentatni ligandi. Kelatni ligandi su polidentatni ligandi koji sasvim obuhvate centralni atom poput škara morskog raka.
litij → lithium
Litij je 1817. godine otkrio Johan August Arfvedson (Švedska). Ime su mu dali Arfvedson i Berzelius od grčke riječi lithos što znači stijena jer je litij otkriven u stijenama za razliku od druga dva elementa prve skupine, kalija i natrija, koji su dobiveni iz biljnog materijala. To je mekani, srebrno bijeli metal koji sporo reagira s kisikom iz zraka. Može se zapaliti na zraku, a u reakciji s vodom razvija vodik iako manje burno nego natrij. Litij je najjače redukcijsko sredstvo. Rijetko se nalazi u većim koncentracijama. Najčešće se javlja u obliku aluminosilikata kao što je spodumen (LiAlSi2O6). Litij je najlakši metal. Upotrebljava se za legiranje aluminija i za izradu specijalnih stakala i keramike. Zbog svog velikog elektrokemijskog potencijala koristi se kao anoda u baterijama.
luminiscencija → luminescence
Luminiscencija (latinski lumen znači svjetlo) je zajednički naziv za pojave emisije elektromagnetskog zračenja (UV, vidljivog ili IR) atoma ili molekula kao posljedica prijelaza elektrona iz pobuđenog u niže energetsko stanje, obično u osnovno stanje. Kako se pojava svijetljenja odvija bez zračenja topline naziva se i hladno svjetlucanje. Može biti izazvana kemijskim procesom (kemoluminiscencija), biološkim procesom (bioluminiscencija), djelovanjem alfa i ß-zraka (radioluminiscencija), svjetlosti (fotoluminiscencija), električne struje (elektroluminiscencija), topline (termoluminiscencija), mrvljenjem (triboluminiscencija) i sl.
S obzirom na trajanje sekundarnog zračenja luminescencija se dijeli na:
- fluorescenciju - traje samo dok djeluje pobuda
- fosforescenciju - sekundarno zračenje traje i nakon prestanka pobude.
lizin → lysine
Lizin je nabijena aminokiselina s baznim pobočnim lancem. Amino skupina u pobočnom lancu je vrlo reaktivna i često je dio aktivnog mjesta u enzimima. Lizin ima značajnu ulogu u koordinaciji negativno nabijenih liganada. To je esencijalna aminokiselina koju ljudski organizam ne može sintetizirati te se mora unijeti preko hrane.
- Kratice: Lys, K
- IUPAC ime: 2,6-diaminoheksanska kiselina
- Molekularna formula: C6H14N2O2
- Molekularna masa: 146.19 g/mol
makromolekule → macromolecule
Makromolekule su molekule visoke relativne molekularne mase (preko 10 000), čija se struktura sastoji od višestrukog ponavljanja molekula niske relativne molekularne mase. Osim u sintetskim polimerimerima makromolekule se mogu naći i u prirodnim polimerima (ugljikohidratima, lipidima, bjelančevinama itd.). Celuloza je prirodni polimer (polisaharid) nastao spajanjem stotina, ponekad i tisuća molekula glukoze.
mangan → manganese
Mangan je 1774. godine otkrio Johann Gahn (Švedska). Ime je dobio od latinske riječi magnes što znači magnet jer se smatralo da je piroluzit (MnO2) - magnesia nigra vrsta magnezita. To je sivo-bijeli metal sličan željezu ali tvrđi i krtiji. Onečišćeni oblik je reaktivan. Izložena površina se oksidira. Otapa se u razrijeđenim kiselinama oslobađajući vodik. Udisanje manganova praha, para ili spojeva, naročito viših oksida može biti smrtonosno. Mangan je po rasprostranjenosti u Zemljinoj kori deseti element. U prirodi se pojavljuje u obliku manganita(Mn2O3·H2O), piroluzita (MnO2), hausmanita (Mn3O4), rodokrosita (MnCO3) i psilomelana (BaMn9O16(OH)4). Elementarni mangan se može dobiti redukcijom rude s aluminijem. Kao feromangan troši se u velikim količinama u metalurgiji. Mangan čeliku izvanredno povećava tvrdoću i otpornost na trošenje, te se od njega izrađuju željezničke tračnice i čeljusti drobilica.
Citiranje ove stranice:
Generalić, Eni. "Linearni oblik molekule." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav