ekvivalentna masa → equivalent weight
Ekvivalentna masa tvari koja sudjeluje u neutralizacijskoj reakciji jest ona količina tvari (molekule, iona ili ionskog para) koja ili reagira s 1 mol vodikovih iona u toj reakciji ili ga proizvodi.
Ekvivalentna masa sudionika oksidacijsko/redukcijske reakcije jest ona masa tvari koja izravno ili neizravno troši 1 mol elektrona.
koenzim q → coenzyme q
Koenzim Q (CoQ) ili ubikinon pripada skupini supstituiranih derivata benzokinona koji se razlikuju samo u duljini izoprenskog dijela pokrajnjeg lanca. Svi prirodni oblici CoQ netopivi su u vodi ali su topivi u lipidima membrane gdje sudjeluju kao mobilni prenositelj elektrona. Koenzim Q esencijalna je komponenta mitohondrijskog elektron-transportnog lanca u većini prokariotskih i svim eukariotskim stanicama.
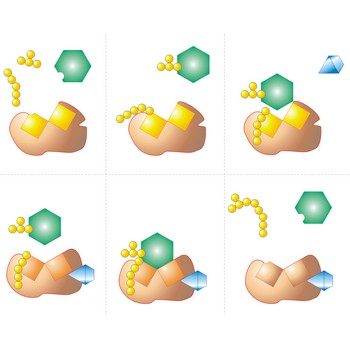
teorija sudara → collision theory
Teorija sudara je teorija koja objašnjava kako se događaju kemijske reakcije i zašto se mijenja brzina reakcije. Da bi se reakcija dogodila moraju se molekule reaktanta sudariti. Samo dio sudara, uspješni sudari, uzrokuje kemijske promjene. Uspješni sudari imaju dovoljno energije (aktivacija energija) u trenutku sudara da prekinu postojeće veze i stvore nove veze, stvarajući reakcijske produkte. Povećavanje koncentracije reaktanata i povišenje temperature povećava broj sudara, odnosno dovodi do povećanja brzine reakcije.
fermentacija → fermentation
Fermentacija (vrenje) je skup biokemijskih reakcija koje dovode do pucanja složenih organskih molekula u jednostavnije tvari. (npr. raspad šećera u alkohol i CO2). Fermentaciju kataliziraju enzimi.
prvi zakon termodinamike → first law of thermo-dynamics
Prvi zakon termodinamike glasi: Energija se ne može stvoriti ni uništiti, ali može prijeći iz jednog oblika u drugi.
koloidni ion → colloid ion
Koloidni ioni nastaju kada koloidne čestice adsorbiraju određenu vrstu iona iz otopine i nabiju se istovrsnim nabojem. Naboj može potjecati i od kemijske reakcije površine čestice. Koloidne ione nastale adsorpcijom na čestice srebrova klorida možemo prikazati kao
Adsorbirani sloj je monomolekulski (debljine jedne molekule) a koji će koloidni ion nastati, ovisi o tome koji je ion u suvišku. Kako su sada koloidne čestice istoimeno nabijene, dolazi do uzajamnog odbijanja i stabiliziranja koloidne otopine. Naboj koloidne čestice može se ustanoviti elektroforezom.
koncentracija → concentration
1. Koncentracija je skupina od četiri veličine kojima se karakterizira sastav otopine u odnosu na njen volumen (masena, količinska, volumenska i brojčana koncentracija).
2. Koncentracija je kraći oblik pisanja količinske (množinske) koncentracije.
kondenzacija → condensation
1. Kondenzacija je proces u kojem plin prelazi iz plinovitog u tekuće agregatno stanje, obično je uzrokovana hlađenjem.
2. Kondenzacija u koloidnim sustavima označava proces skupljanja manjih čestica u veće čestice koloidnih dimenzija.
3. Kondenzacija je vrsta kemijske reakcije u kojoj se izdvajaju male molekule kao što su molekule vode, amonijaka, ugljikova dioksida.
uvjetni elektrodni potencijal → conditional electrode potential
Uvjetni ili formalni elektrodni potencijal (E°’) jednak je elektrodnom potencijalu (E) kada su ukupne koncentracije oksidiranog i reduciranog oblika u svim njihovim oblicima u otopini jednake jedinici. Uvjetni elektrodni potencijal obuhvaća utjecaje reakcija koje izravno ne sudjeluju u izmjeni elektrona, ali dovode do promjene ionske jakosti, promjene pH, hidrolize, kompleksiranja, taloženja itd.
Pri 298 K (25 °C) i pretvarajući prirodne logaritme u dekadske, možemo Nernstovu jednadžbu za elektrodni potencijal pisati kao
Citiranje ove stranice:
Generalić, Eni. "Linearni oblik molekule." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav