talij → thallium
Talij je 1861. godine otkrio Sir William Crookes (Engleska). Ime je dobio od grčke riječi thallos što znači propupala grančica zbog karakteristične zelene linije u atomskom spektru. To je srebrno sivi, veoma mekani metal koji se može rezati nožem. Oksidira na zraku pa se čuva u petroleju. Otapa se u svim kiselinama. Talij je otrovan za ljude i životinje. Nekad se upotrebljavao za uništavanje glodavaca i insekata ali je to napušteno zbog posrednog trovanja divljih životinja i ptica. Spojevi su visoko toksični ako se unesu u organizam, a naročito su opasni zbog svog kumulativnog efekta. Talij se nigdje ne javlja u većim količinama. Dobiva se kao nusproizvod prerade sulfidnih ruda cinka, olova, željeza i bakra. Najviše se upotrebljava u elektronici, za proizvodnju posebnog optičkog stakla s velikim indeksom loma i infracrvenih detektora.
kositar → tin
Kositar je poznat od davnih vremena (~2000. godine prije Krista). Rimljani su ga zvali stagnum od čega je nastao latinski naziv stannum. Naziv kositar dolazi od grčkog naziva za mineral kasiterit (SnO2) - kassiteros. To je srebrno bijeli, mekani, elastični metal čija se izložena površina prevuče zaštitnim oksidnim filmom. Stabilan je na zraku i u vodi. Topljiv je u kiselinama i lužinama. Organski spojevi kositra mogu biti jako toksični. Najvažnije rude kositra su kasiterit (SnO2), stanit (Cu2FeSnS4) i tealit (PbZnSnS2). Zbog svoje stabilnosti na zraku upotrebljava se kao zaštitna prevlaka na mnogim metalima, osobito željezu (bijeli lim). Vrlo važna primjena kositra je za dobivanje legura (bronca, bijele ležajne kovine, legura za lemljenje).
toksin → toxin
Toksini su specifični i veoma učinkoviti otrovi koje proizvode živi organizmi. Obično se sastoje od aminokiselinskog lanca čija molekulska težina varira od nekoliko stotina (peptidi) do nekoliko stotina tisuća (bjelančevine). Oni, također, mogu biti i niskomolekularni organski spojevi. Toksine proizvode brojnih organizmi, primjerice bakterije, gljivice, alge ili biljke. Mnogi su od njih ekstremno otrovni; toksičnost im je i za nekoliko redova veličina veća od živčanih bojnih otrova. Botulin, toksin koji proizvodi bakterija Clostridium botulinum, najotrovnija je poznata tvar.
trioli → triols
Trioli su organski spojevi koji sadrže tri hidroksilne skupine. Najjednostavniji triol jest 1,2,3-propantriol, CH2(OH)CH(OH)CH2(OH), koji je također poznat pod nazivom glicerol (grčki glykys što znači slatko) ili glicerin. Glicerol se u komercijalne svrhe proizvodi hidrolizom masti.
Glicerol je sporedni produkt u proizvodnji sapuna.
Wohlerova sinteza → Wohler’s synthesis
Wöhlerova sinteza je sinteza uree koju je 1828. izveo njemački kemičar Friedrich Wöhler (1800.-1882.). On je otkrio da urea (CO(NH2)2) nastaje kada se otopina amonijeva izocijanata (NH4NCO)ispari do suha. Njegova proizvodnja uree iz anorganskog spoja bila je značajno otkriće jer se u to vrijeme vjerovalo da organske tvari mogu sintetizirati samo živi organizmi.
cink → zinc
Cink je 1746. godine otkrio Andreas Marggraf (Njemačka). Ime mu dolazi od njemačke riječi zinke što znači zubac zbog pojavljivanja cinkovog karbonata u rudama zupčastog oblika. To je plavkasto-bijeli metal koji je na sobnim temperaturama krt ali postaje kovak kada se zagrije pri 100 °C do 150 °C. Otapa se u lužinama i kiselinama. Na zraku je stabilan jer mu na površini nastane sloj oksida koji ga štiti od dalje korozije. Gori na zraku kada se zagrije do crvenog žara. Burno reagira s oksidansima. Cinka u Zemljinoj kori ima oko sto puta više nego bakra. Glavne rude su mu sfalerit (ZnS) i smitsonit (ZnCO3). Glavna namjena cinka je zaštita željeza i čelika (pocinčano željezo). To se postiže umakanjem očišćenog željeza u talinu cinka. Cink štiti željezo i kad se obloga ošteti. Upotrebljava se za dobivanje različitih legura kao što je mjed (legura cinka i bakra) i kao anoda u galvanskim člancima (baterijama).
dipolarni ion → zwitterion
Dipolarni ili dvojni ion (zwitterion), poznat i kao unutarnja sol, jest ion koji ima pozitivan i negativan naboj na različitim mjestima iste molekule. Kako ion na sebi istovremeno ima suprotne naboje električki je neutralan. Dipolarni ioni nastaju iz spojeva koji u svojim molekulama imaju i kisele i bazne skupine (amfoliti).
Sve aminokiseline koje se mogu naći u bjelančevinama (proteinima) su amfoliti je sadrže kiselu karboksilnu skupinu (-COOH) i baznu amino skupinu (-NH2). Aminokiseline u čvrstom stanju nalaze se u obliku dipolarnog iona. Dodatkom kiseline u otopinu koja sadrži dipolarne ione aminokiseline karboksilatna skupina prima proton (H+) i aminokiselina postaje pozitivno nabijena. Dodatkom lužine amino skupina gubi proton pri čemu aminokiselina postaje negativno nabijena.
Dipeptid → Dipeptide
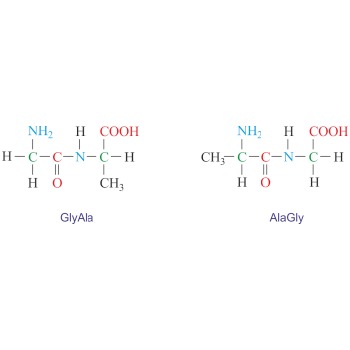
Dipeptid je organski spoj nastao povezivanjem dviju aminokiselina peptidnom vezom. Iz dvije aminokiseline mogu nastati četiri različita dipeptida ovisno o tome koja skupina aminokiseline sudjeluje u stvaranju peptidne veze. Primjerice, glicin (Gly) i alanin (Ala) mogu dati dva simetrična dipeptida (GlyGly i AlaAla) i dva asimetrična (GlyAla i AlaGly). Dipeptidi ime dobivaju tako da formulu čitamo od N-kraja do C-kraja.
Citiranje ove stranice:
Generalić, Eni. "Cyclic compound." Englesko-hrvatski kemijski rječnik & glosar. 29 June 2022. KTF-Split. {Datum pristupa}. <https://glossary.periodni.com>.
Glosar
Periodni sustav